
Contoh Soal Hukum Faraday Homecare24
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Oktober 2, 2023 Oleh Eka, S.Si. Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya. Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.

Bunyi Dan Rumus Hukum Faraday 1 Dan 2
Jika rumus hukum Faraday 1 dan 2 ini digabungkan, maka akan diperoleh rumus baru, yaitu: G = k . i . t . ME. Keterangan: k = tetapan/faktor pembanding. Faraday menemukan bahwa harga faktor pembanding ini adalah 1/96.500, sehingga rumus di atas dapat dituliskan sebagai berikut.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Contoh Soal Hukum Faraday dan Pembahasan. 1. Berapa gram kalsium yang dapat dihasilkan dari elektrolisis lelehan CaCl 2 dengan elektroda grafit selama satu jam jika digunakan arus 10 A? (A r Ca = 40) Jawab: Massa Ca yang dihasilkan dapat dihitung dengan rumus: Diketahui i = 10 A; t = 1 jam = 3.600 s
Hukum Faraday 1 Amp 2 Pengertian Rumus Dan Contoh Soal Riset
Pengertian dan Bunyi hukum Faraday 1 dan 2☑️ Rumus (persamaan), Contoh Soal dan pembahasan hukum Faraday 1 dan 2 lengkap☑️ Seorang ilmuwan yang berasal dari Inggris bernama Michael Faraday menemukan sebuah hukum yang digunakan dalam ilmu kimia dinamakan Hukum Faraday. Hubungan antara penggunaan muatan listrik dan hasil massa zat dalam electrode dijelaskan melalui hukum ini.

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 1) YouTube
Oke kalian sudah paham ya tentang Hukum Faraday 1 dan hukum faraday 2, selanjutnya kita akan lihat beberapa contoh soal hukum faraday nih, Squad.. Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday: w = 1/96.500 x I x t x ME. dengan,

Mengenal Bunyi Hukum Faraday Kimia Kelas 12
Hai pengunjung! Yuk simak rumus hukum Faraday 1 dan 2 yang merupakan landasan penting dalam memahami induksi elektromagnetik. Rumus ini digunakan untuk menghitung besarnya arus dan medan magnet yang terjadi akibat perubahan fluks magnetik. Dengan memahami rumus ini, kamu akan mampu mengaplikasikannya secara efektif dalam berbagai perhitungan teknik dan ilmu pengetahuan lainnya.

Rumus Praktis Hukum Faraday Pojok Kimia
Rumus Hukum Faraday 1 Dan 2. Dalam sebuah Hukum Faraday, secara matematis perhitungan arus listrik dapat dirumuskan menjadi: Rumus Hukum Faraday untuk menghitung suatu gaya gerak listrik maka, rumus yang digunakan secara sistematis ialah sebagai berikut: ɛ = -N (ΔΦ / ∆t) Keterangan: ɛ ialah gaya gerak listrik (ggl) induksi (volt)
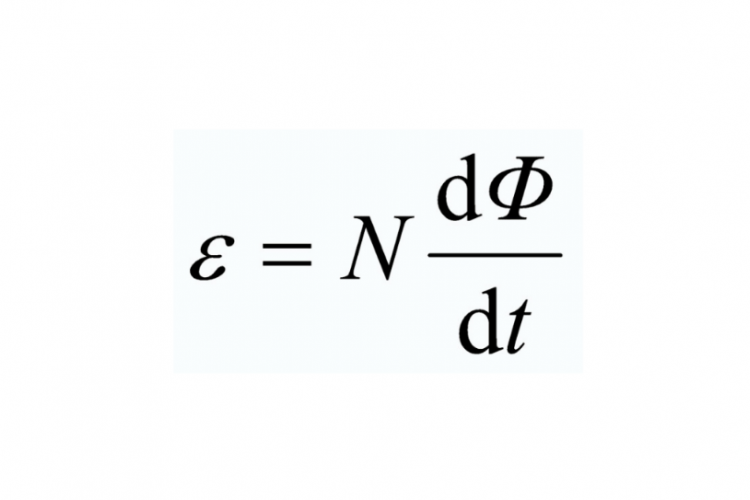
Contoh Soal Hukum Faraday I dan II Lengkap dengan Kunci Jawabannya
Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1. Ingat, bunyi hukum Faraday 1: "Massa zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan" Berdasarkan bunyinya, rumus hukum Faraday 1 dapat dituliskan sebagai berikut. G ≈ Q atau G ≈ it. Keterangan:

Pembahasan Soal Elektrolisis Hukum Faraday 1 dan 2 YouTube
Rumus Hukum Faraday. Hukum Faraday 1 dan penjelasan lebih detil mengenai rumus Hukum Faraday 2. Rumus Hukum Faraday 1: Hukum Faraday 1 menyatakan: "Massa zat yang terbentuk selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan." Rumus Hukum Faraday 1 dapat dinyatakan sebagai berikut: M = Q * E. Dimana:

Pengertian Hukum Faraday Dilengkapi Bunyi Rumus Dan Contoh Soal Riset
Rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1. Ingat, hukum 1 Faraday berbunyi: "Massa suatu zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan" Berdasarkan bunyinya, rumus hukum Faraday 1 dapat ditulis sebagai berikut. G ≈ Q atau G ≈ itu. Informasi: G = massa yang.

Contoh Soal Hukum Faraday 1 LEMBAR EDU
2. Rumus Hukum Faraday 2. Bunyi hukum Faraday II: "Massa zat yang dilepaskan pada elektrolisis berbanding lurus dengan massa ekuivalen zat itu". Berdasarkan bunyi hukum Faraday 2 tersebut, maka rumusnya adalah: Keterangan: ME = massa ekivalen. x = jumlah elektron yang diterima atau dilepaskan. Jika rumus hukum Faraday 1 dan 2 ini.

Foto Hukum Faraday I dan II tentang Elektrolisis Halaman 1
Bunyi Hukum Faraday 1 dan 2, Beserta Rumus Faraday. Bunyi Hukum Faraday - Pengertian Hukum Faraday adalah salah satu hukum yang menyatakan bahwa hubungan antara jumlah listrik yang dipakai dengan Massa Zat yang dihasilkan pada proses Elektrolisis baik di Katoda maupun Anoda, dan Teori Faraday ini sering disebut juga dengan Teori Kuantitatif.

Soal Dan Pembahasan Hukum Faraday Ruang Ilmu
Keterangan. W : Massa zat yang dihasilkan (gram) e : Massa ekuivalen. i : Kuat arus (ampere) t : Waktu (secon). F : Tetapan Faraday = 96.500 Coulomb/mol. 𝑄=𝑖×𝑡. Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram.
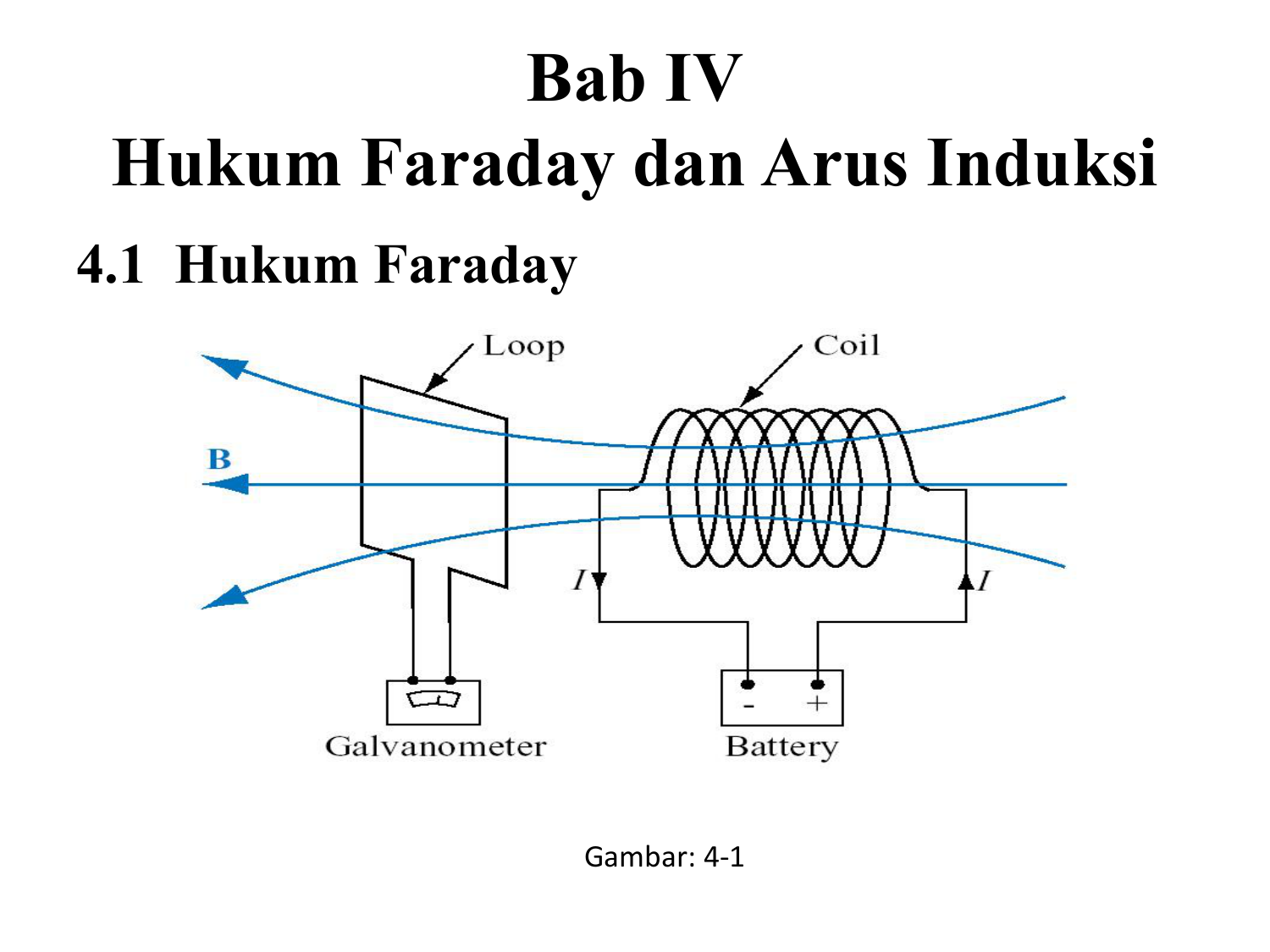
Hukum Faraday dan Arus Induksi
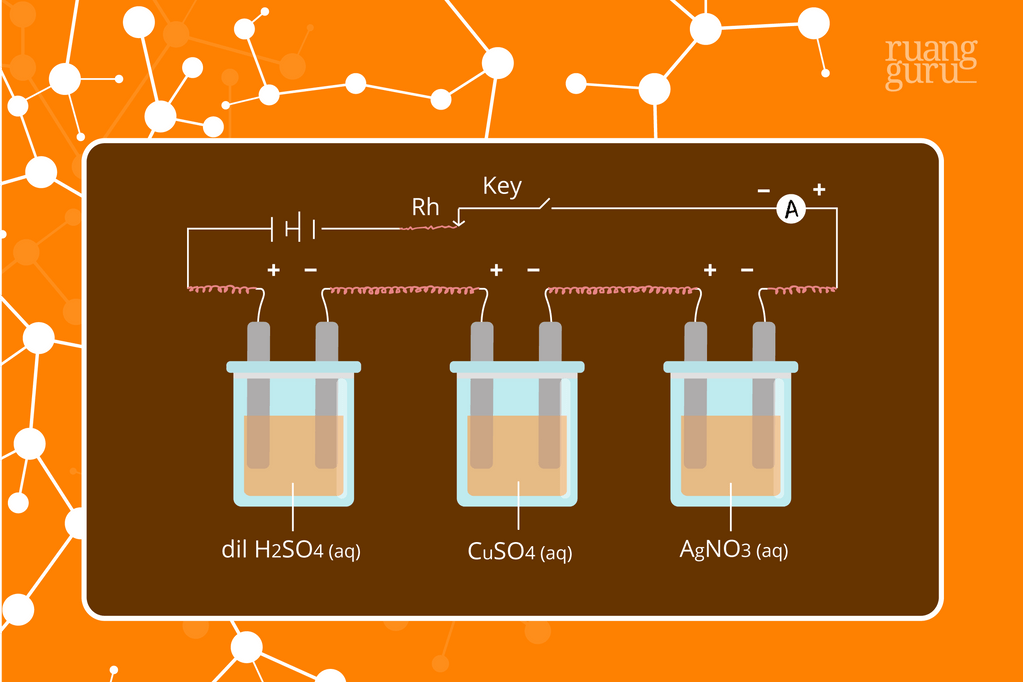
Hukum Faraday dibagi menjadi dua, yaitu Hukum Faraday 1 dan 2. 1. Hukum I Faraday. Hukum I Faraday berbunyi "Total zat yang dihasilkan pada elektroda, berbanding lurus dengan total muatan listrik yang mengalir melalui sel elektrolisis.". Arus listrik sebesar 0,2 ampere mengalir selama 2 jam melalui larutan Co (NO 3) 2.
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
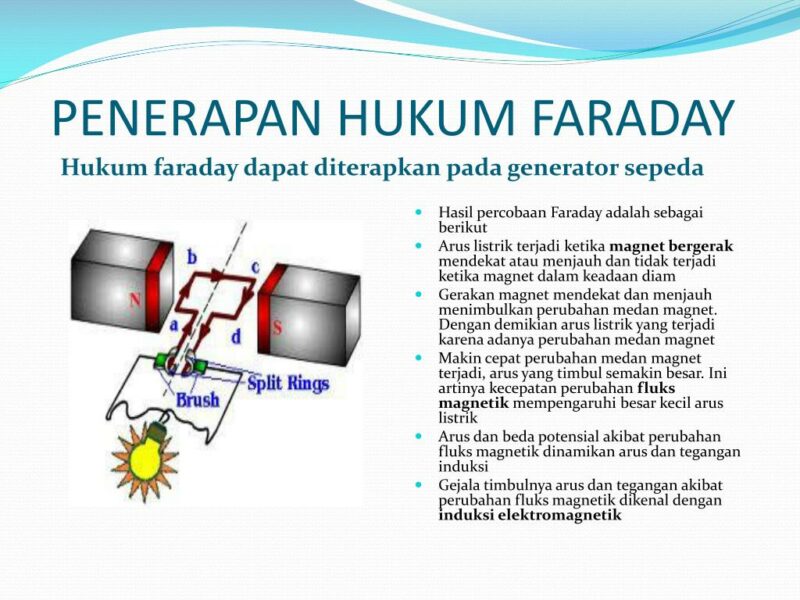
Bunyi Hukum Faraday. Dari percobaan yang telah dilakukan oleh Michael Faraday di atas, maka Faraday menyimpulkan dua pernyataan yang selanjutnya disebut dengan Hukum Faraday 1 atau Hukum Induksi Elektromagnetik Farady 1 dan Hukum Faraday 2 atau Hukum Induksi Elektromagnetik 2. Adapun bunyinya sebagai berikut ini: Hukum Faraday 1

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Rumus hukum Faraday II adalah W1 / W2 = e1 / e3, W1 adalah massa zat 1 (gram), W2 adalah massa zat 2 (gram), ei adalah ekuivalen zat 1 dan e2 adalah ekuivalen zat 2. Penjelasan ini menegaskan jika memang adanya penerapan hukum ini dipakai untuk memperhitungkan aspek kuantitatif zat-zat yang terlibat dalam reaksi di dalam sel elektrolisis.