
Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Zat yang dapat bertindak sebagai asamsekaligus bas. Iklan. Pertanyaan. Zat yang dapat bertindak sebagai asam sekaligus basa disebut.. indikator. zat amfoter. asam Lewis. ion pembatas. pasangan konjugasi.

Cara Menentukan Senyawa Bersifat Asam Basa Atau Netral Digunakan
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Spesi berikut yang berperan sebagai asam Lewis adalah.
Pengertian Asam Basa. 1. Asam. Asam adalah senyawa kimia yang apabila dilarutkan didalam air, maka akan menghasilkan larutan dengan pH lebih kecil dari 7. Asam adalah sebuah zat yang bisa memberi proton (ion H+) terhadap zat lain (basa), atau bisa menerima pasangan elektron bebas dari sebuah basa.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
Asam dan Basa; Perkembangan Konsep Asam dan Basa; Zat yang dapat bertindak sebagai asam sekaligus basa disebut. a. indikator b. zat amfoter c. asam Lewis d. ion pembatas e. pasangan konjugasi.. Air keras yang digunakan dalam proses pewarnaan batik men. Tonton video.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Halo Rahmat, kakak bantu jawab yaa. Jadi, zat yang dapat bertindak sebagai asam sekaligus basa disebut amfoter. Yuk perhatikan penjelasan berikut agar kamu lebih memahaminya. Amfoter berkaitan erat dengan amfiprotik, namun arti kedua istilah ini agak berbeda. Spesi amfoter dapat bertindak baik sebagai asam maupun basa.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
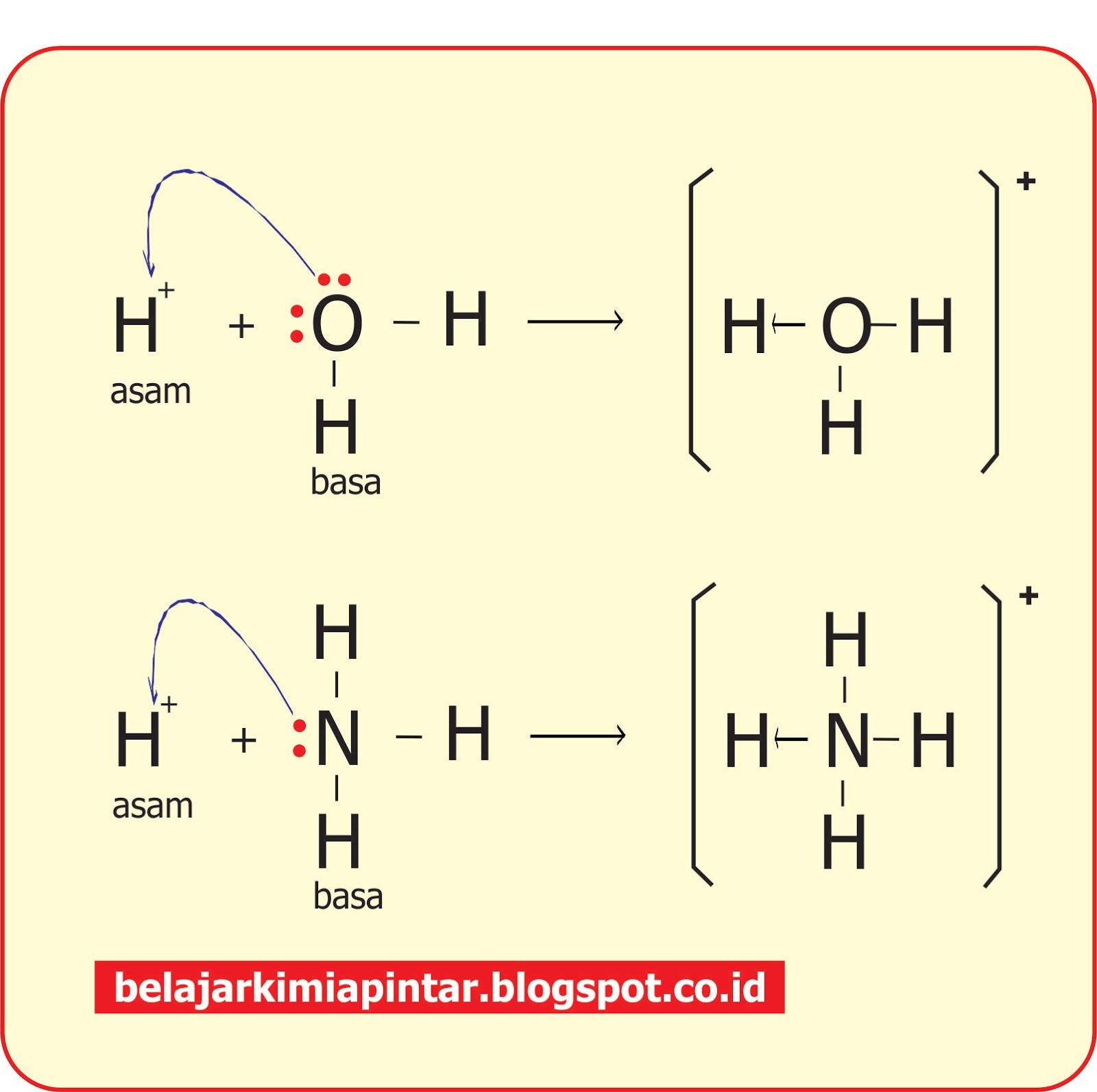
Molekul H2O disebut juga zat amfoter karena sifatnya yang dapat bertindak sebagai asam dan basa. Teori Asam-Basa Lewis Pada tahun 1932 G. N. Lewis, seorang ahli kimia dari UC Berkeley mengusulkan teori alternative untuk menggambarkan asam dan basa.

Asam dan Basa Konjugasi
Penggunaannya dalam asam basa, amfoter berarti senyawa yang bisa menjadi keduanya. Terkadang istilah lain yang juga digunakan untuk senyawa yang dapat menjadi asam maupun basa adalah amfiprotik. Antara Amfoter dan Amfiproti memiliki makna yang sama. Ringkasan Pada teori asam basa Bronsted-Lowry dapat diperoleh beberapa poin penting diambil.
Apa Yang Dimaksud Dengan Asam dan Basa?
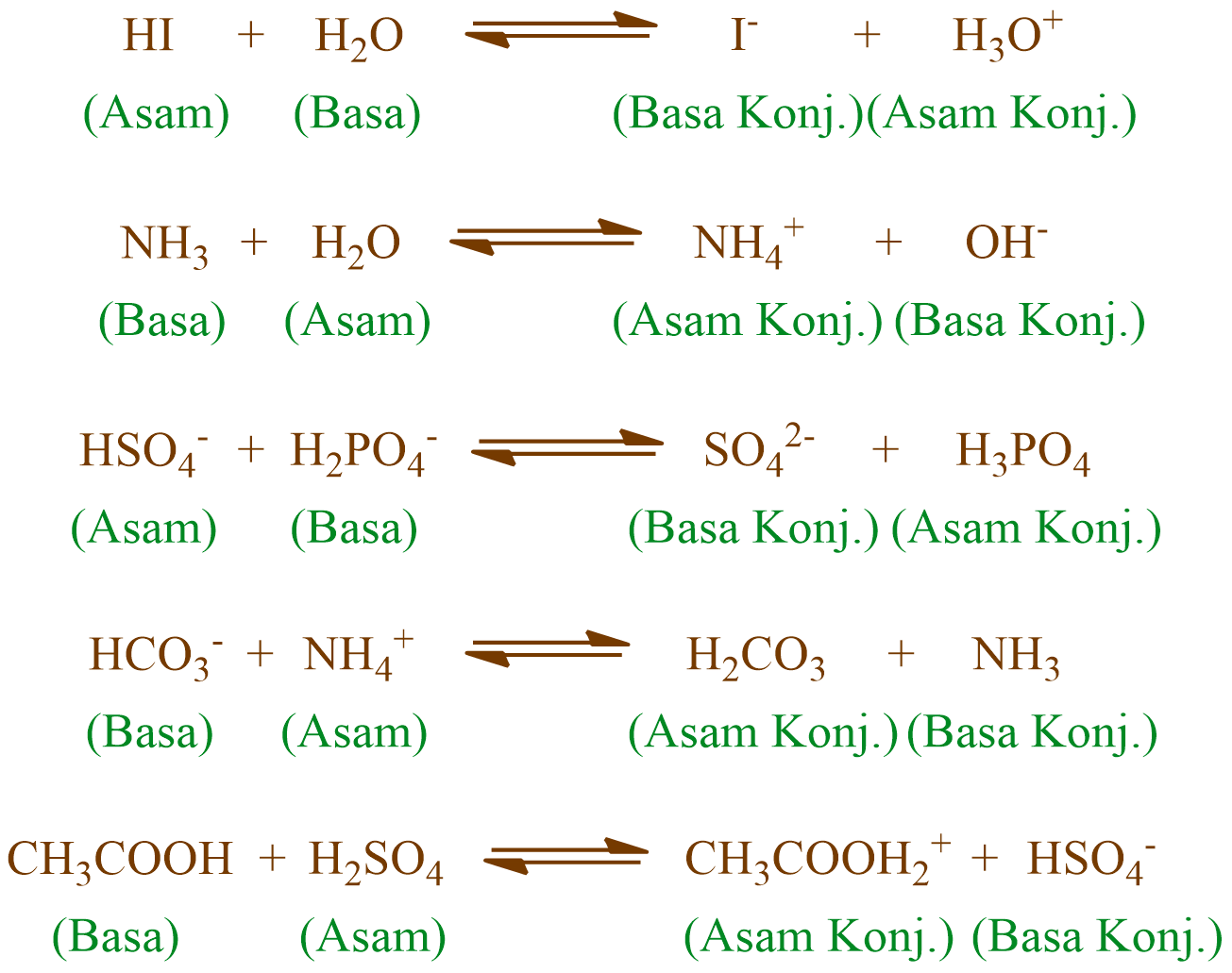
Suatu zat dapat dikatakan bersifat amfiprotik jika zat tersebut dalama suatu reaksi dapat bertindak sebagai pendonor atau akseptor proton. Dari keempat zat di atas, zat yang bersifat sebagai asam atau basa menurut teori Bronsted-Lowry adalah HC 2 O 4- dan H 2 O. Berikut reaksi yang menunjukkan sifat tersebut. 2.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Senyawa yang bertindak sebagai asam basa Bronsted Lowry disebut amfoter. Sementara itu, konsep asam basa Bronsted Lowry bisa dijelaskan bahwa asam.

Teori Asam Basa
Asam adalah zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain. Basa adalah zat yang memiliki kecenderungan untuk menerima ion H+ dari zat lain adalah basa. Senyawa yang bertindak sebagai asam-basa Bronsted-Lowry disebut amfoter. Perhatikan reaksi berikut ini: Ca(OH) 2 (aq) Ca2+ (aq) + 2OH (aq)

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
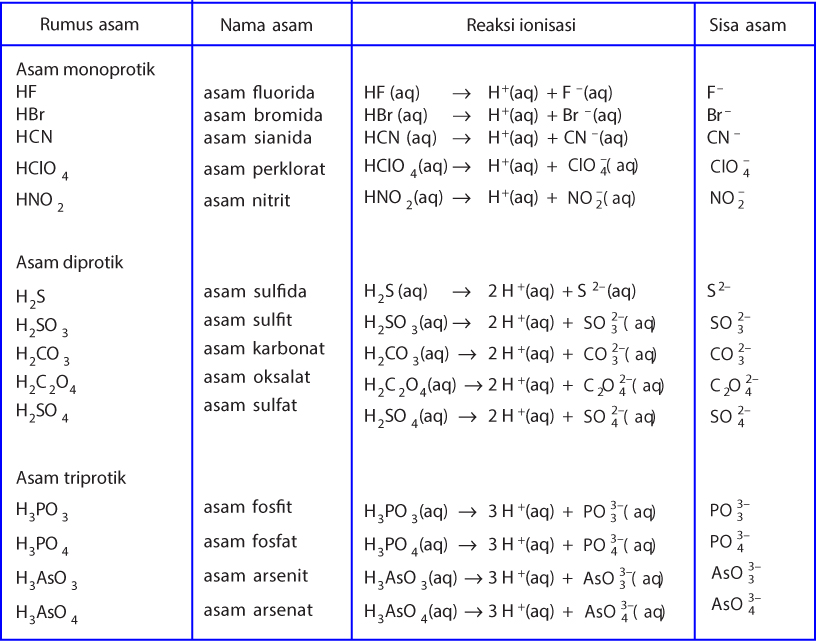
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Pengertian asam basa dan garam berserta contohnya PR Sekolahku
Asam = donor H+. Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20.
Teori Asam Basa Lewis KIMIA OKE PINTAR
Arrhenius menyatakan bahwa asam adalah molekul yang ketika dilarutkan dalam air akan melepaskan ion H + atau menyumbangkan H + atau dapat disebut donor proton. Sedangkan basa adalah senyawa yang bila dilarutkan dalam air akan melepaskan ion OH -. Contoh asam Arrhenius yaitu HCl dimana dalam air akan terionisasi. HCl H + + Cl -.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Pada gambar di sebelah kanan, satu molekul H2O bertindak sebagai basa dan mendapatkan H + menjadi H3O+ sementara lainnya bertindak selaku asam dan kehilangan H+ dan menjadi OH −. Contoh lain dapat dilihat pada aluminium hidroksida Al (OH)3. Asam Basa pH - Rumus Kimia - Penjelasan, Contoh Soal dan Jawaban.

Zat yang dapat bertindak sebagai asam sekaligus basa dise...
Ia mendefinisikan bahwa asam sebagai suatu zat yang bisa menerima sepasang elektron, sedangkan basa adalah zat yang dapat memberikan sepasang elektron. Contoh reaksi asam basa Lewis adalah reaksi antara Na 2 O dan SO 3. Na 2 O + SO 3 → Na 2 SO 4. Baca Juga: Pengertian Larutan dan Klasifikasinya - Kimia Kelas 11. Contoh Soal dan Pembahasan.