
Konsep Mudah Menentukan Titik Didih dan Titik beku (Sifat Koligatif Larutan ) Kimia SMA YouTube
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

1 .Sifat Koligatif Larutan _ c. Kenaikkan Titik Didih dan Penurunan Titik Beku Larutan YouTube
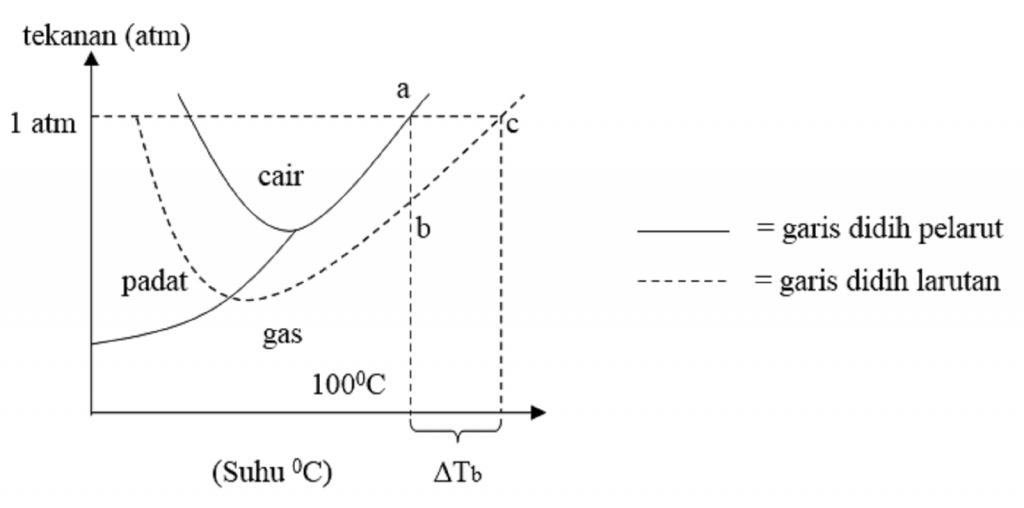
T b° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis zat terlarut. Jika ditambahkan zat terlarut yang tidak mudah menguap, misalnya gula, maka dibutuhkan kenaikan titik didih yang cukup besar agar dapat mendidih.

SOAL LATIHAN KIMIA TITIK BEKU DAN TITIK DIDH Rozezisme
Penurunan titik beku cairan pendingin membantu dalam proses pendinginan dan pemindahan panas ini. Penggunaan Baterai Dalam cuaca yang sangat dingin, penurunan titik beku dapat mempengaruhi kinerja baterai kendaraan. Suhu rendah dapat mengurangi kapasitas baterai dan menghambat reaksi kimia dalam baterai.
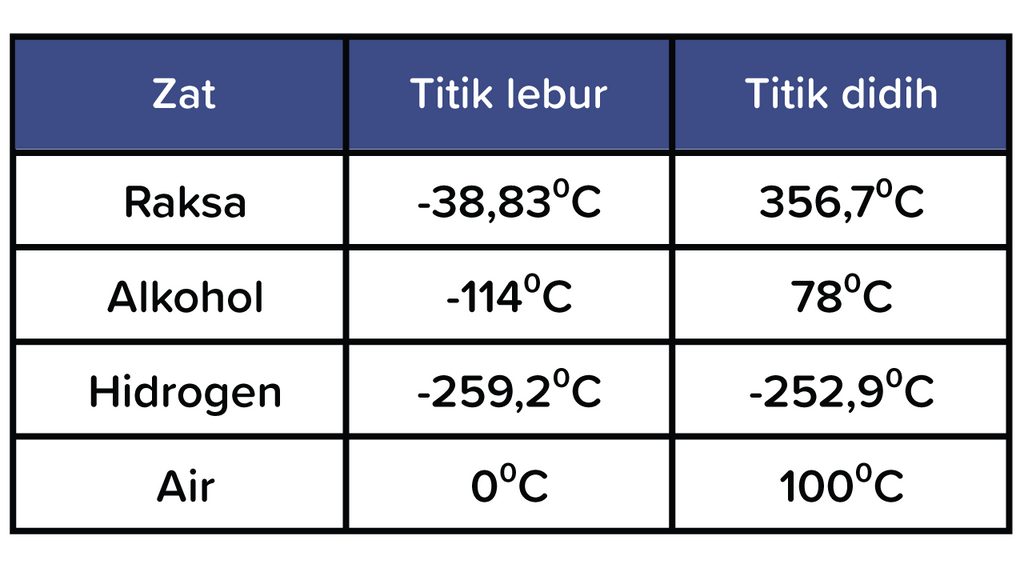
Perhatikan data titik lebur dan titik didih dari e...
Titik beku menggambarkan transisi cair ke padat sedangkan titik leleh adalah suhu di mana air berubah dari padat (es) ke air cair. Secara teori, kedua suhu akan sama, tetapi cairan dapat didinginkan di luar titik bekunya sehingga tidak memadat sampai jauh di bawah titik beku. Biasanya, titik beku air dan titik leleh adalah 0 °C atau 32 °F .

Grafik titik didih, beku dan cair Kimia SMA YouTube
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.

Sulastri buku142 Tugas 131 Contoh Soal Tentukan titik didih dan titik beku 6,20 g larutan
Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang ikut terlarut di dalamnya. Berikut rumus persamaan untuk menentukan penurunan titik beku yang sebanding dengan hasil kali molalitas (m) dengan nilai penurunan titik beku molal (Kf). ΔTf = m x Kf. Keterangan:
Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
tentukan titik didih dan titik beku larutan yang mengandung 18 gram glukosa , Mr 180 dalam 500 gram air. jika kb dan kf diketahui. sifat koligatif larutan..

Soal Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
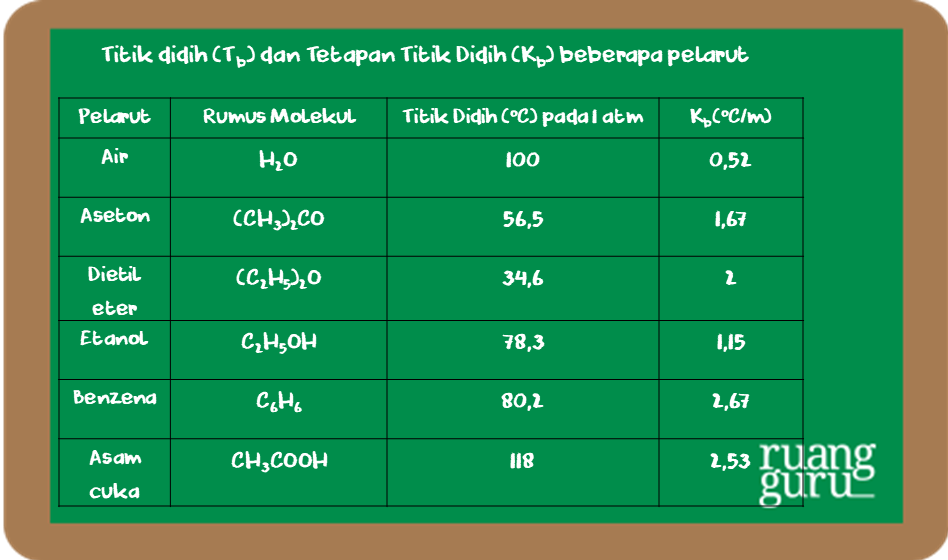
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K b). Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb.

Membaca grafik titik didih dan titik beku larutan, pelarutsifat koligatif YouTube
Perlu diketahui, titik didih normal adalah titik didih pada tekanan normal, yaitu tekanan udara luar sebesar 1 atmosfer (atm) atau 76 cmHg. Baca juga: Cara Mencari Jumlah Kalor yang Dibutuhkan untuk Menaikkan Suhu. Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat.

Laporan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Besarnya kenaikan titik didih dan penurunan titik beku bergantung pada konsentrasi zat terlarut (Syukri, S. 1999) Penurunan titik beku berbanding lurus dengan penurunan tekanan uap, atau berbandingnya lurus dengan fraksi mol dan untuk larutan encer, keseimbangan ini dapat dianggap berlaku pula terhadap molalitas.
Kenaikan Titik Didih Dan Penurunan Titik Beku Riset
Pengertian Titik Beku (Freezing Point) Titik beku (freezing point) adalah suhu tertentu di mana suatu zat berubah dari fase cair menjadi fase padat. Pada titik beku, molekul-molekul atau atom-atom dalam zat bergerak lebih lambat dan memiliki energi lebih rendah, sehingga zat tersebut membeku. Titik beku biasa digunakan untuk bahan yang dalam.

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan : ΔTf ≈ m ΔTf = Penurunan titik beku Atau Kf =Tetapan kenaikan titik beku m = Molalitas ΔTf = Kf x m Tf = 0°C - ΔTf Kf disebut tetapan penurunan titik beku molal. Nilai Kf untuk benzena 5,12 °C m-1.

Rumus titik beku larutan
Agar tidakterjadi pemisahan zat terlarut dan fpelarutnya ketika larutan membeku, diperlukan suhu lebih rendah lagiuntuk mengubah seluruh larutan menjadi fasa padatnya. Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan : ΔTf ≈ m ΔTf = Penurunan titik beku Atau ΔTf = Kf x mTf = 0°C - ΔTf Kf.

Tentukan titik didih, titik beku, dan tekanan osmotic dari larutan 0,1 mol Ba(NO3)2 dalam 500 gr
Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan. Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram. Mr = 60.

Titik Didih Dan Titik Beku
Identifikasi Miskonsepsi Penurunan Titik Beku dan K enaikan Titik Didih pada . Mahasiswa Pendidikan Kimia . Darius Agung 1, Cindy Fauziah 2, dan Hajidah Salsabila Allissa Fitri 3.
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Pengertian Titik Didih dan Titik Beku. Titik Didih: Titik didih adalah suhu tertentu di mana tekanan udara sekitar zat adalah 1 atmosfer (atau sekitar 101.3 kPa). Pada titik ini, zat cair akan mengalami penguapan secara cepat sehingga berubah menjadi fase gas. Setiap zat memiliki titik didih yang unik dan dapat dipengaruhi oleh tekanan atmosfer.