
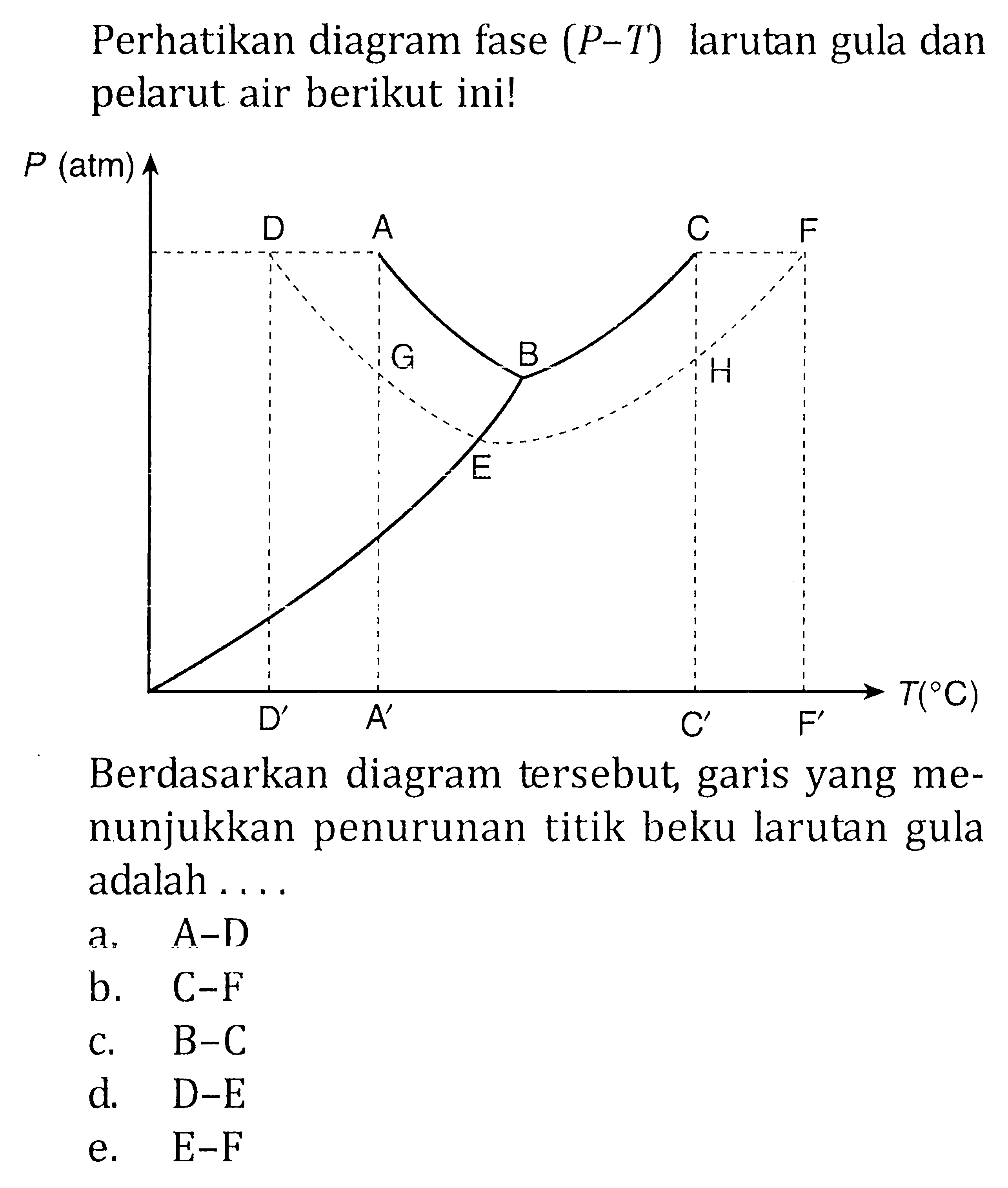
Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Penurunan titik beku adalah salah satu sifat koligatif larutan yang dipengaruhi oleh beberapa faktor. Faktor-faktor yang mempengaruhi penurunan titik beku meliputi: Konsentrasi Partikel Terlarut: Semakin tinggi konsentrasi partikel terlarut dalam larutan, semakin besar penurunan titik beku yang terjadi. Ini berarti larutan dengan konsentrasi.
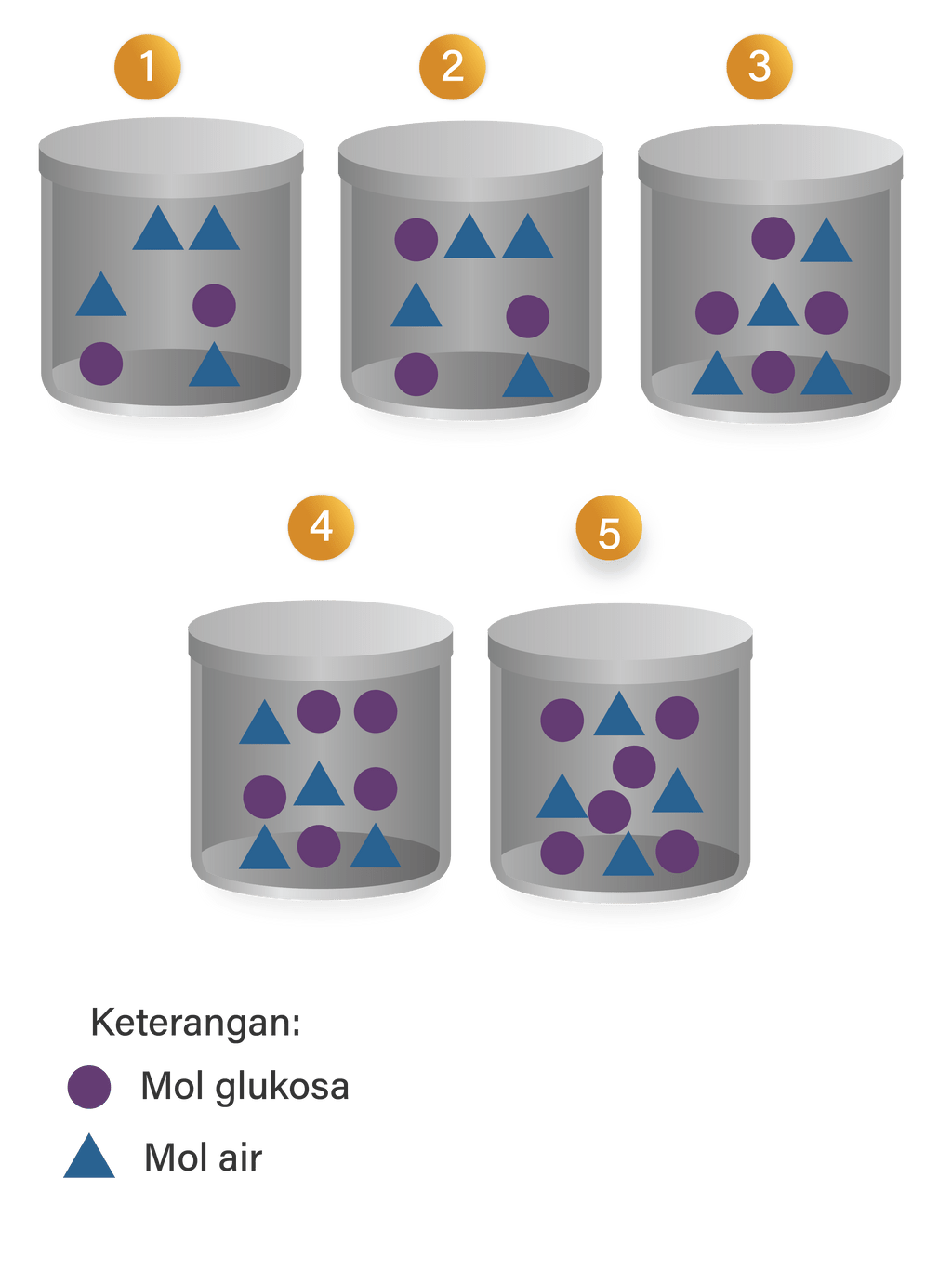
Perhatikan bagan berikut Larutan yang mem...
Titik beku adalah suhu dimana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah dari pada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama dari pada pelarut. Setiap larutan memiliki titik beku yang berbeda.
Larutan berikut yang memiliki titik beku paling tinggi ad...
Tf larutan (Tb) = Titik beku larutan (°C) Tf pelarut (Tb°) = Titik beku pelarut (°C) ΔTf = Penurunan titik beku (°C) m = Molalitas larutan (molal). Jadi, larutan yang isotonik dengan C6H12O6 0,3 M adalah larutan CaCl2 0,1 M. 4. Tekanan uap jenuh air pada suhu 28⁰C adalah 100 mmHg. Apabila 30 gram urea (Mr=60) dilarutkan dalam 2 mol.

Berikut data titik beku (Tf) beberapa larutan elektrolit
Sifat koligatif larutan adalah sifat-sifat yang hanya bergantung pada jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut - tidak peduli dalam bentuk atom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang "kuantitas", bukan "kualitas".

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
LAPORAN PRAKTIKUM KIMIA PENURUNAN TITIK BEKU LARUTAN. Titik beku adalah suhu dimana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah daripada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama daripada pelarut.

Berikut disajikan data percobaan tentang titik beku beber...
Dalam persamaan di atas, T F adalah titik beku normal dari pelarut murni (273 K untuk air, contohnya); a liq adalah aktivitas pelarut dalam larutan (aktivitas air untuk larutan berair); ΔH fus T F adalah perubahan entalpi fusi dari pelarut murni pada T F, yaitu 333.6 J/g untuk air pada 273 K; ΔC fus p adalah perbedaan antara kapasitas panas.

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Larutan berikut yang memiliki titik beku paling tinggi ad...
Kemudian, adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah. Baca Juga: Pengertian Senyawa Polimer. Nah, berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Titik beku larutan lebih rendah pelarut murni. Titik beku adalah suhu saat suatu zat menjadi beku di bawah tekanan 1 atm. Misalnya air, air adalah pelarut murni yang memiliki titik beku 0°C. Artinya, air yang awalnya cair akan berubah menjadi padat pada suhu 0°C. Dilansir dari Thought Co, larutan memiliki titik beku yang lebih rendah daripada.

Ppt Pembentukan Larutan Dan Konsentrasi Larutan Powerpoint Riset
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. 2. Diketahui Mr Urea (CO(NH2)2) = 60 g/mol, Kf air = 1,86 0 C/m, dan tekanan uap pelarut air pada suhu 25 0 C sebesar 23,75 mmHg, dan tekanan uap larutan urea pada 25 0 C sebesar 22,56 mmHg. Titik beku larutan urea tersebut adalah…

Data percobaan penurunan titik beku Larutan Konsentrasi
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. [3] Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
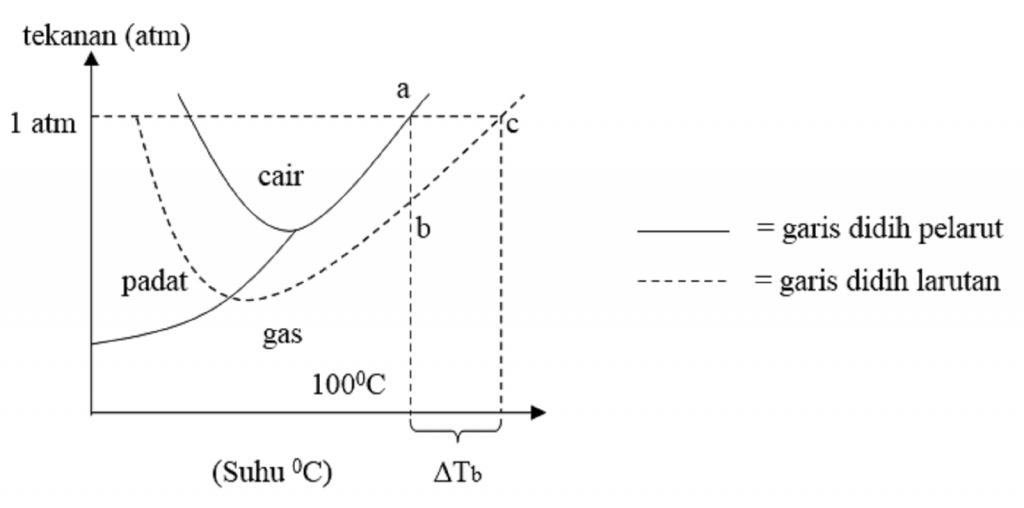
Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Titik beku heksana, yang merupakan senyawa hidrokarbon alifatik, adalah sekitar -95 derajat Celsius atau -139 derajat Fahrenheit. 18.Hidroklorida (HCI) Titik beku larutan asam hidroklorida tergantung pada konsentrasi. Sebagai contoh, larutan 20% HCl memiliki titik beku sekitar -27 derajat Celsius atau -16.6 derajat Fahrenheit. 19.Helium

Praktikum Penurunan Titik Beku Pada Pembuatan Es Krim II Sifat Koligatif Larutan YouTube
Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat. Adapun titik beku besarnya sama dengan titik lebur yakni 0°C. Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan

Penurunan Titik Beku Larutan Adalah Reverasite
Berikut adalah contoh soal materi sifat koligatif larutan kelas 12 semester 1 serta jawabannya. 1. Semua sifat berikut tergolong sifat koligatif larutan, kecuali.. A. Penurunan Tekanan Uap. B. Kenaikan Titik Didih. C. Penurunan Titik Beku. D. Tekanan Osmosis. E. Kepekatan Larutan.

Larutan yang memiliki titik beku paling rendah adalah.
Sifat koligatif larutan itu ada empat macam, yaitu p enurunan tekanan uap (Δ P), penurunan titik beku (Δ Tf), kenaikan titik didih. Contoh dari larutan nonelektrolit adalah larutan gula seperti glukosa, sukrosa dan maltosa, larutan urea (CON 2 H 4), serta larutan alkohol seperti metanol,.

Rumus titik beku larutan
Misalnya, titik beku normal air adalah 0 o C. Akan tetapi, dengan adanya zat terlarut pada suhu 0 o C, air bisa mejadi belum membeku. Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf