
Reaksi Redoks dan Elektrokimia Kimia Kelas 12 • Part 12 Hukum Faraday YouTube
Belajar Modul, Rumus, & Soal Elektrolisis dan kuis interaktif.. Terdapa 2 Hukum Faraday Kimia yakni hukum faraday 1 dan hukum faraday 2, lebih lanjut seperti berikut: 1. Hukum Faraday I "Massa zat yang terjadi atau melarut selama proses electrolysis berbanding lurus dengan jumlah muatan listrik yang melalui sel elektrolisis kimia.

Rumus Hukum Faraday Bentuk turunan II YouTube
Hukum Faraday dirumuskan oleh ahli kimia dan fisika asal Inggris, Michael Faraday. Pada 1833, Faraday menjelaskan penemuan tentang aspek kuantitatif dari elektrolisis yang akhirnya menghasilkan dua hukum elektrolisis Faraday.. Rumus hukum Faraday II adalah W1 / W2 = e1 / e3, W1 adalah massa zat 1 (gram), W2 adalah massa zat 2 (gram), ei.

Hukum Faraday Dalam Elektrolisis YouTube
Dalam kimia, Rumus Faraday Kimia sangat berguna dalam menghitung jumlah muatan listrik yang terlibat dalam reaksi elektrokimia. Dengan mengikuti langkah-langkah yang benar dan menggunakan rumus dengan tepat, Anda dapat mendapatkan hasil perhitungan yang akurat.

Mengenal Bunyi Hukum Faraday Kimia Kelas 12
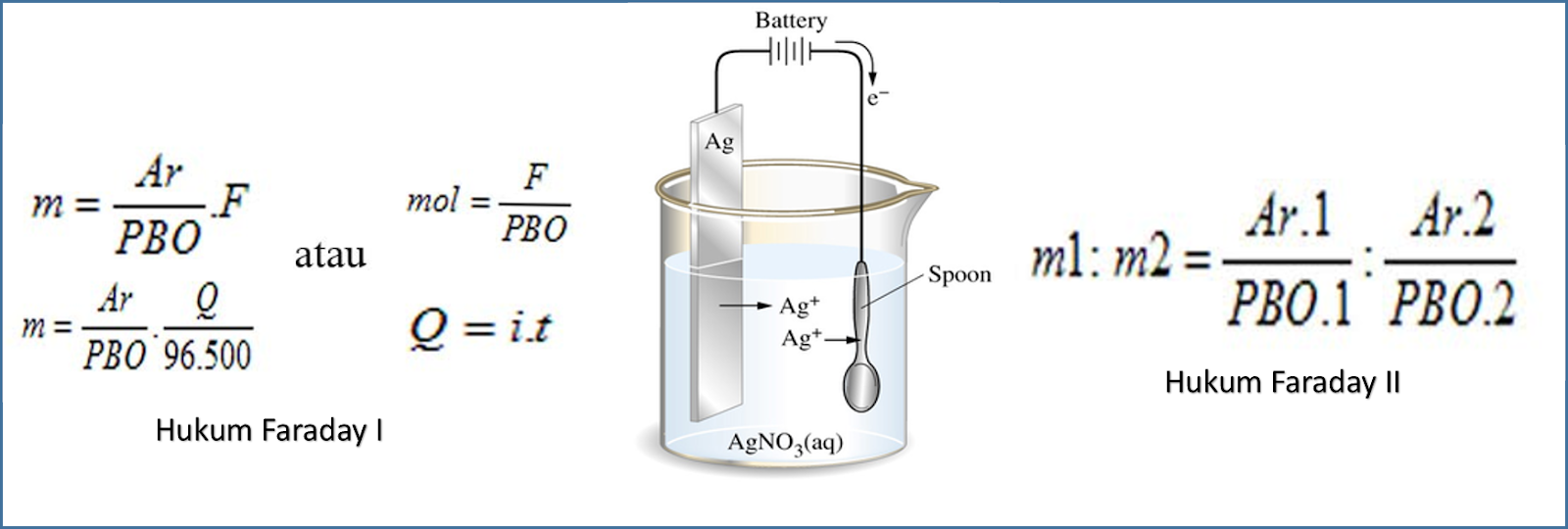
Menurut Modul Kimia yang diterbitkan Kemendikbud menyimpulkan bahwa W=Q dengan rumus hukum Faraday I adalah W = e.i.t/F. W adalah massa zat yang dihasilkan dengan ketentuan gram. e adalah massa ekivalen. i adalah kuat arus dengan ketentuan ampere. t adalah waktu dengan ketentuan sekon. F adalah tetapan Faraday yakni 96.500 Coulomb/mol.

Mengenal Bunyi Hukum Faraday Kimia Kelas 12
Michael Faraday, ia adalah seorang ilmuan asal Inggris yang lahir pada 22 September 1791 di Newington Butts, Inggris. Kemudian ia dijuluki sebagai "bapak listrik", berkat usahanya listrik bisa jadi teknologi yang memiliki banyak kegunaan. Michael Faraday menjadi seorang ahli kimia dan fisika berkat mempelajari aspek kuantitatif dan.
Hukum Faraday Pojok Kimia
2. Berapa jumlah faraday untuk mereduksi ion Ca2+ sebanyak 12 gram? Jawab: Ca2+ → valensi = 2. Ar Ca = 40. W = e x F. Sehingga, untuk mereduksi 12 gram ion Ca2+ diperlukan 0,6 Faraday. Demikianlah pembahasan materi pengertian hukum faraday, bunyi, rumus, penerapan dan contoh soal tentang hukum faraday.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Faraday juga banyak mempopulerkan istilah-istilah kimia, seperti elektroda, elektrolit, anoda, katoda, dan sebagainya. Kini, hukum Faraday banyak digunakan secara luas pada berbagai bidang industri. Rumus Hukum Faraday. Selain memiliki bunyi yang berbeda, hukum Faraday 1 dan 2 juga memiliki rumus yang berbeda.
faraday law of induction
Faraday juga banyak mempopulerkan istilah-istilah kimia, seperti elektroda, elektrolit, anoda, katoda, dan sebagainya. Rumus Hukum Faraday Selain memiliki bunyi yang berbeda, hukum Faraday 1 dan 2 juga memiliki rumus yang berbeda. Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1 G ≈ Q atau G ≈ it Keterangan:

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 1) YouTube
Aspek kuantitatif dari elektrolisis dirumuskan oleh Michael Faraday, seorang ahli kimia dan fisika dari Inggris, dalam dua hukum elektrolisis Faraday.. Muatan listrik yang digunakan dihitung dengan rumus: Q = i × t. Diketahui i = 1,93 A; t = 5 menit = 300 s. Q = (1,93 A)(300 s) = 579 C.

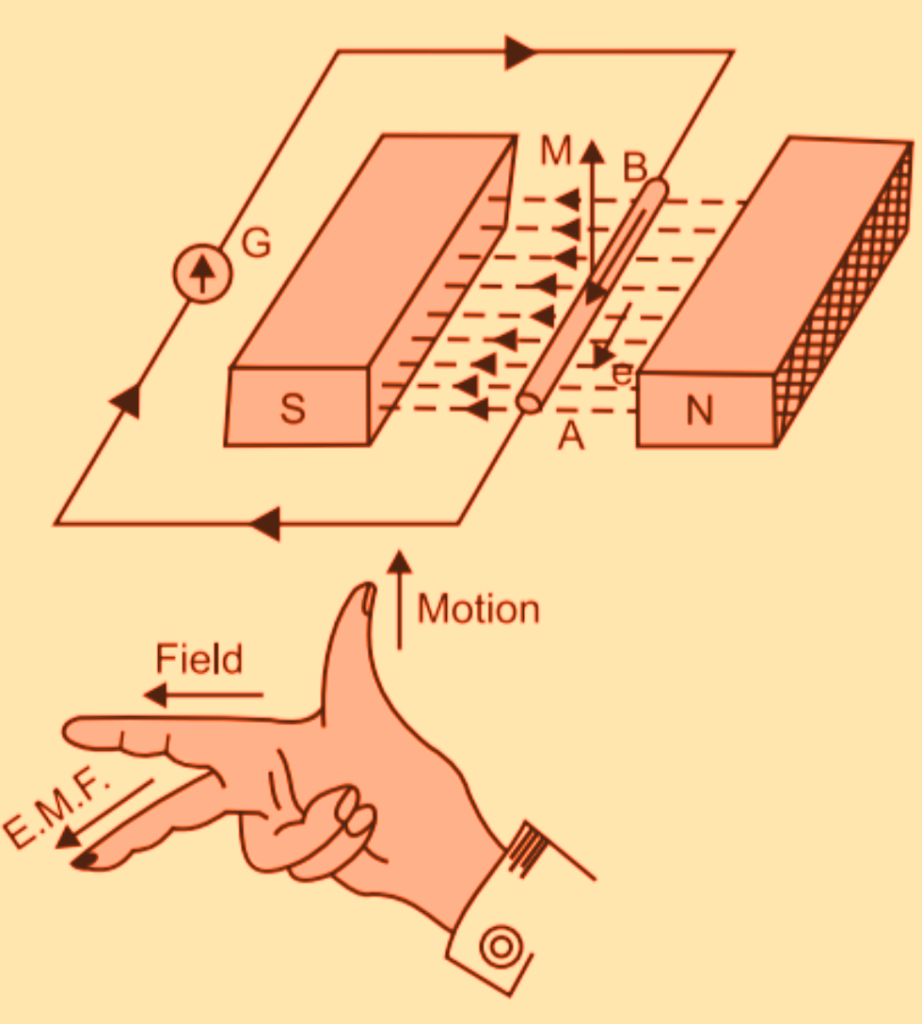
Faraday's Law of Induction YouTube
Hukum Faraday - Pada postingan sebelumnya kita telah belajar tentang elektrolisis yang merupakan proses penguraian zat-zt kimia oleh arus lisrik searah. Dalam peristiwa tersebut terjadi proses perubahan bentuk energi dari energi listrik menjadi energi kimia melalui sel elektrolisis. Nah hubungan kuantitatif antara muatan listrik dengan perubahan kimia ini dijelaskan melalui hukum Faraday.

K403 RedOks Elektrolisis (Penurunan Rumus Hukum Faraday) YouTube
Secara sistematis, Hukum Faraday I dapat disimpulkan dengan persamaan berikut: w ≈ Q. Keterangan : w = massa zat (kg) Q = muatan listrik dalam elektron (C) Baca : Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya. Jumlah muatan listrik yang dipakai (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).

Hukum Faraday Pengertian, Bunyi, Rumus, dan Contoh Soalnya Quipper Blog
Dalam Modul Kimia yang diterbitkan Kemdikbud, diketahui rumus hukum Faraday 1 dinyatakan dengan: W = e . i . t / F. Keterangan: W adalah massa zat yang dihasilkan (gram) e adalah massa ekuivalen. i adalah kuat arus (ampere) t adalah waktu (sekon) F adalah tetapan Faraday yaitu 96.500 Coulomb/mol

Contoh Soal Hukum Faraday Homecare24
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Oktober 2, 2023 Oleh Eka, S.Si. Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya. Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.

Rumus Praktis Hukum Faraday Pojok Kimia
Hukum Faraday: Penerapan Dan Contoh Soal - Hukum Faraday menjelaskan tentang hubungan proses kimia dengan energi listrik. Proses ini sudah banyak dikenal diberbagai industri sebagai proses elektrolisis, yaitu proses perpindahan muatan listrik pada suatu larutan yang menghasilkan proses kimia pada larutan tersebut. Hukum Faraday ini dirumuskan dengan : W = e.F Dengan : W = massa

Faraday’s law of induction/ online presentation
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Pada tahun 1834, seorang ilmuwan bernama Michael Faraday merumuskan suatu hukum terkait hubungan antara arus listrik yang dialirkan ke dalam larutan dengan banyaknya zat kimia yang dihasilkan. Percobaan dari Michael Faraday ini kemudian menghasilkan Hukum Faraday I dan Hukum Faraday II.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Bunyi Hukum Faraday 1 dan Hukum Faraday 2. Untuk Bunyi Hukum Faraday 1 berbunyi, " Massa Zat yg dibebaskan dan dihasilkan didalam Elektroda selama Elektrolisis berbanding lurus dengan Jumlah (Muatan) Listrik yang ditransfer pada Elektroda tersebut. Maka Jumlah Listrik tersebut adalah Muatan Listrik yang memiliki satuan Coulomb (C) ".