
Rumus Koreksi Elektrolit Dll
Adapun pada larutan elektrolit dan nonelektorlit, maka rumus sifat koligatif larutan menjadi seperti berikut. Penerapan sifat koligatif larutan dalam kehidupan sehari-hari Penerapan Penurunan Tekanan Uap Pelarut. Mendapatkan Benzena Murni menggunakan pemisahan campuran dengan distilasi bertingkat, menggunakan prinsip perbedaan tekanan uap.

Contoh Larutan Elektrolit Kuat Dan Lemah Berbagai Contoh
ΔP = Xter x P0. Zat terlarut menurunkan tekanan uap pelarut. sifat koligatif. Rumus sifat koligatif larutan mempunyai delapan rumus yang terbagi menjadi empat rumus sifat koligatif larutan non elektrolit dan empat rumus sifat koligatif larutan elektrolit.

Contoh Soal Tekanan Osmosis (Sifat Koligatif Larutan Elektrolit) YouTube
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya. Kamu dapat download modul & contoh soal serta kumpulan latihan soal Elektrolit & Reaksi Penggaraman dalam bentuk pdf pada link dibawah ini: Modul Elektrolit & Reaksi Penggaraman.

Persamaan Ionisasi Senyawa Elektrolit Dalam Air Berikut Yang Benar Adalah Terbaru
Belajar Modul, Rumus, & Soal Aplikasi Elektrokimia dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Aplikasi Elektrokimia lengkap di Wardaya College.. (elektrolit) disebut setengah sel. Dua interaksi yang mungkin di antara keduanya akan menghasilkan kesetimbangan berikut : $\mbox{M}(s)\rightleftharpoons\mbox{M}^{n+}(aq)+ne^{-}$
Contoh Larutan Elektrolit Dan Non Elektrolit Lengkap Berbagai Contoh
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi.

Rumus Konduktivitas Larutan Elektrolit dan Derajat Dissosiasi Statmat.id Gerak, Gantungan
Larutan elektrolit adalah larutan yang mengandung ion-ion dari suatu zat yang larut atau terurai sehingga larutan dapat menghantarkan arus listrik. Misalnya, larutan garam dapur (NaCl), asam sulfat (H 2 SO 4 ), dan natrium hidroksida (NaOH). Sedangkan larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik.

Konsep Mudah Menentukan Titik Didih, Titik Beku Dan Tekanan Osmotik Larutan Elektrolit KIMIA
Larutan elektrolit dalam sebuah baterai. Elektrolit adalah suatu zat yang larut atau terurai ke dalam bentuk ion-ion dan selanjutnya larutan menjadi konduktor elektrik, ion-ion merupakan atom -atom bermuatan elektrik. Elektrolit bisa berupa air, asam, basa atau berupa senyawa kimia lainnya. Elektrolit umumnya berbentuk asam, basa atau garam.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Larutan Elektrolit dan non elektrolit dilihat pada kemampuan menghantarkan listrik. Larutan Elektrolit dapat menghantarkan listrik, non elektrolit tidak dapat.. Rumus Derajat Disosiasi (α): Nilai α dapat berubah - ubah antara rentang 0 - 1, kriteria derajat disosiasi (α) memenuhi ketentuan berikut.

Contoh Elektrolit Dan Bukan Elektrolit Devyntrust
Pembahasan: Oleh karena perbandingan massa / Mr sama, molaritas akan sama dan tekanan osmotik pun sama. Jadi, tekanan osmotiknya sebesar (A) 2 atm. Nach demikian share materi kimia kali ini mengenai Rumus dan Contoh Soal Tekanan Osmotik Larutan Elektrolit. Semoga materi kimia di atas dapat memberikan manfaat bagi kita semua.

Derajat Ionisasi Larutan Elektrolit YouTube
Rumus ini dapat digunakan untuk menghitung konsentrasi larutan elektrolit. Sebagai contoh, mari kita hitung konsentrasi ion klorida (Cl-) dalam larutan 0,1 M HCl. Karena HCl merupakan elektrolit kuat, maka seluruh senyawa akan terionisasi menjadi H+ dan Cl-. Oleh karena itu, konsentrasi ion klorida sama dengan konsentrasi HCl, yaitu 0,1 M.

Koreksi Elektrolit PDF
Belajar di Wardaya College. Materi larutan elektrolit & non elektrolit menjadi salah satu materi yang menjadi bagian utama dalam ilmu kimia. Di dalam materi ini, kamu akan memahami bahwa di dalam ilmu kimia, kamu tidak hanya membuat larutan biasa, tapi kamupun bisa membuat larutan yang mampu menghantarkan listrik.

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Elektrolisis: Pengertian, Reaksi, Rumus, Contoh Soal. Dalam kehidupan sehari-hari, elektrolisis biasa digunakan untuk penyepuhan logam supaya tidak mudah berkarat. Misalnya penyepuhan perak pada peralatan rumah tangga. Dalam proses penyepuhannya, logam yang akan disepuh dijadikan katoda yang akan mengalami reduksi, sedangkan logam penyepuhnya.

(DOC) Rumus Koreksi Elektrolit Dll DOKUMEN.TIPS
Perbedaan Larutan Elektrolit dan Larutan Non Elektrolit. Larutan elektrolit dan larutan non elektrolit mempunyai karakteristik atau sifat yang berbeda. Berikut ini adalah perbedaannya; Sifat dari larutan elektrolit; Bisa menghantarkan listrik. Mempunyai derajat ionisasi yang berkisar antara 0 < α ≤ 1. Apabila dilakukan uji daya hantar.

Keseimbangan cairan & elektrolit
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.
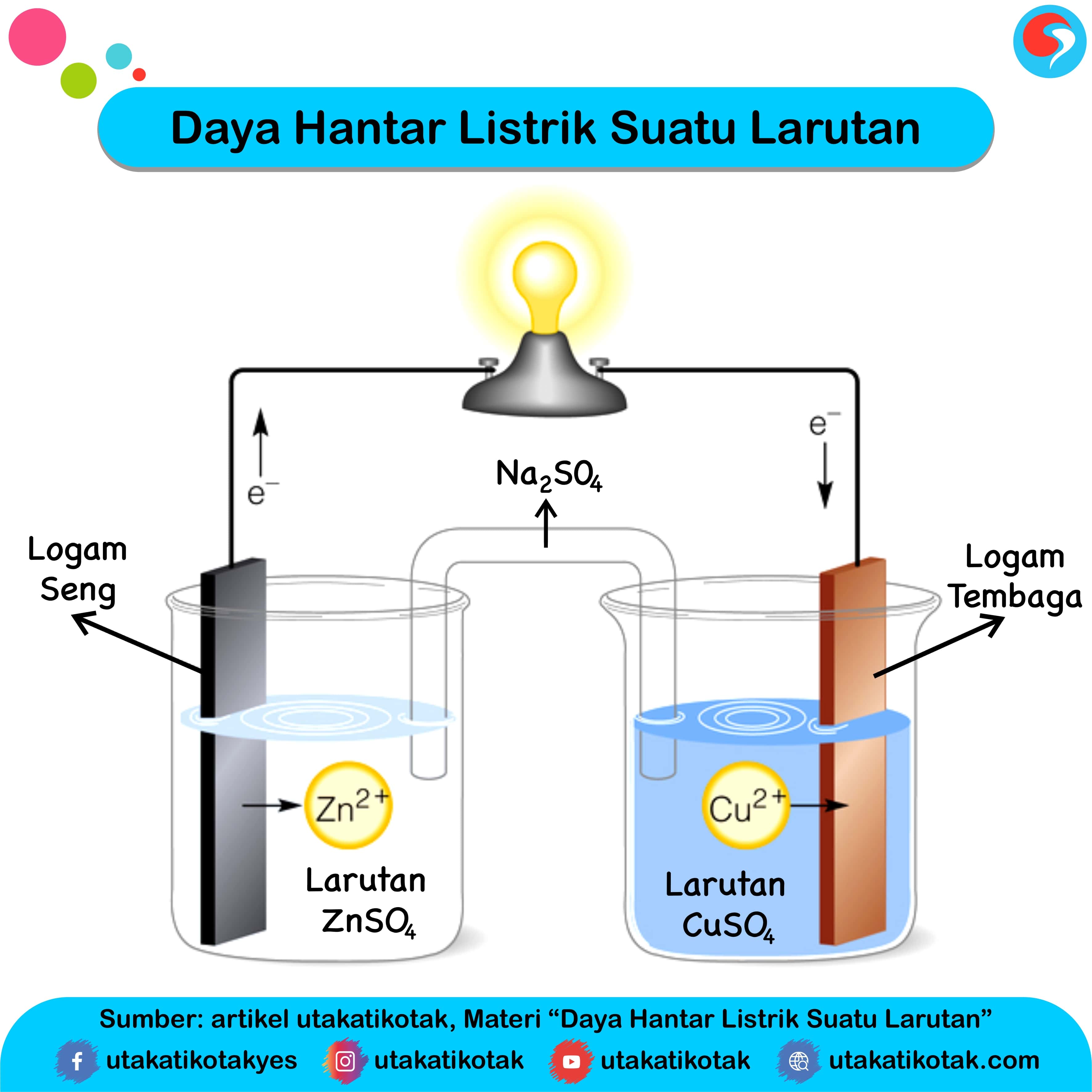
Daya Hantar Listrik Suatu Larutan
Jumlah partikel larutan elektrolit lebih banyak daripada larutan non-elektrolit sehingga sifat koligatifnya pun akan lebih besar. Nilai dari sifat koligatif larutan non-elektrolit dapat diketahui dengan rumus-rumus berikut ini: Penurunan tekanan uap ΔP = P⁰. X𝗍 Ket: ΔP: penurunan tekanan uap larutan P⁰: tekanan uap jenuh pelarut murni

Contoh Soal Tekanan Osmosis (Sifat Koligatif Larutan Elektrolit) YouTube
Soal nomor 4. Berapakah derajat ionisasi larutan elektrolit lemah biner dengan konsentrasi 0,1 M pada suhu 27 o C dan tekanan osmotik 4,305. π = M . R . T { 1 + (n-1) α} Jadi larutan biner tersebut mempunyai derajat ionisasi sebesar 0,75. Demikian ulasan mengenai sifat koligatif larutan slektrolit, soal, dan pembahasannya. Semoga manfaat.