
persamaan laju reaksi, UN kimia 2016 pembahasan 024 YouTube
Di sini, kamu akan belajar tentang Persamaan Laju Reaksi melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar). Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya.

Soal dan Penyelesaian Persamaan Laju Reaksi Berdasarkan Data Percobaan YouTube
Menentukan Persamaan Laju Reaksi. Persamaan laju suatu reaksi tidak memiliki hubungan dengan stoikiometri reaksi, tetapi ditentukan melalui percobaan, salah satu metode yang sering digunakan adalah metode laju awal. Menurut cara ini, laju diukur pada awal reaksi dengan konsentrasi yang berbeda-beda. Sebagai contoh pada reaksi antara HCl dan.

LAJU REAKSI Cara menentukan persamaan laju reaksi jika zat yang bereaksi ada tiga YouTube
Persamaan Laju Reaksi: Pengertian dan Faktor Yang Mempengaruhi [Lengkap + Contoh Soal] Ditulis oleh Dianti Kurniatami • 21 Februari 2024. Laju reaksi merupakan salah satu konsep dasar dari Kimia yang membahas mengenai perubahan konsentrasi suatu reaktan atau produk dalam satuan waktu. Laju reaksi sendiri yang dinyatakan dalam persamaan laju.

PERSAMAAN LAJU REAKSI YouTube
Persamaan laju reaksi merupakan sebuah persamaan yang memperlihatkan keterkaitan atau hubungan antara laju reaksi tertentu dengan konsentrasi pereaksinya. Baca juga: Mengenal Energi dan Perubahannya dalam Sistem. Coba kamu perhatikan rumusnya, selain ada tetapan laju reaksi, juga ada orde reaksi. Orde reaksi ini beda dengan orde lama ataupun.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Video ini berisi penjelasan tentang konsep persamaan laju reaksi, makna dan grafik orde reaksi, serta bagaimana menentukan orde reaksi, persamaan laju reaksi.
Persamaan Laju Reaksi dan Orde Reaksi Kimia Kelas 11 YouTube
c. r O2 = - ½ x r SO3 = - ½ x 0,0125 = - 0,00625 M/s. Jadi, laju berkurangnya O2 sebesar - 6,25 x 10-3 M/s. Itulah ulasan tentang Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan terimakasih. Baca juga refrensi artikel.

Persamaan Laju Reaksi dan grafik orde Konsep Mudah YouTube
Modul ini memaparkan tentang konsep laju reaksi dan persamaan laju reaksi. Konsep laju reaksi merupakan prasarat untuk kita mempelajari beberapa konsep lain yang berhubungan misalnya konsep kesetimbangan kimia. Pengetahuan tentang laju reaksi sangat berguna bagi siswa untuk mengembangkan suatu pemikiran tentang pengawetan bahan dan lain-lain.

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
Oleh karena itu persamaan dari materi ini adalah sebagai berikut. Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu. Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?

Laju Reaksi Kimia Kelas 11 • Part 5 Persamaan Laju Reaksi dan Orde Reaksi YouTube
Jadi, laju reaksi saat konsentrasi P 2 Q yang terbentuk adalah 0,8 mol adalah 0,008 M/detik. Jawaban: B. Contoh Soal 8. Perhatikan reaksi berikut. AB + C 2 → ABC 2. Reaksi di atas memiliki persamaan laju reaksi r = k[AB] 2 [C 2]. Tentukan orde reaksi totalnya! Pembahasan: Sebelum menentukan orde reaksi total, kamu harus tahu dulu orde masing.

Persamaan Laju Reaksi Penjelasan, Rumus, Contoh Soal dan Jawaban
Orde reaksi terhadap HCl. Persamaan laju reaksi. r = k [Na 2 S 2 O 3] Soal No. 9. Untuk reaksi: X 2 + Y + Z → XY + XZ, didapatkan data bahwa pada saat konsentrasi X 2 diduakalikan dengan Y dan Z tetap, laju reaksi menjadi dua kali lebih cepat, dan pada konsentrasi X dan Z tetap dengan Y ditigakalikan, laju reaksinya juga menjadi tiga kali.

Soal Pengaruh suhu terhadap laju reaksi YouTube
B. Persamaan Laju Reaksi. Persamaan laju reaksi adalah fungsi dari semua pereaksi yang menentukan laju reaksi. Persamaan laju reaksi juga dikenal dengan hukum reaksi. Persamaan laju reaksi dapat dituliskan sebagai berikut : xA + yB → produk. Rumus Persamaan Laju Reaksi. v = k [A]m [B]n. Keterangan: v = laju reaksi [A] = konsentrasi zat A

Soal Dan Jawaban Laju Reaksi Kimia Kelas Xi Saung Belajar
X= orde reaksi terhadap A Y= orde reaksi terhadap B. Orde reaksi adalah tingkat reaksi suatu zat. Orde reaksi menunjukkan pengaruh konsentrasi suatu zat terhadap laju reaksi. Orde reaksi total dibedakan menjadi orde nol, orde 1, dan orde reaksi dua. Orde reaksi total didapatkan memlalui persamaan: Baca juga: Mendefinisikan Sistem Persamaan.

Pengertian dan Teori Laju Reaksi Materi Kimia Kelas 11
Untuk reaksi banyak-tahap, orde dari setiap tahapan sama dengan molekularitasnya, namun hal ini tidak secara umum tepat bagi laju secara keseluruhan.. Persamaan laju reaksi dengan asumsi mekanisme banyak-tahap terkadang dapat diturunkan secara teoritis menggunakan asumsi keadaan kuasi-tunak dari reaksi elementer yang mendasarinya dan dibandingkan dengan persamaan laju eksperimen sebagai uji.

Persamaan laju reaksi contoh soal kimia SMA YouTube
Persamaan laju reaksi V = k [NO2]2 Berikut ini beberapa orde reaksi yang umum terdapat pada persamaan reaksi: a. Reaksi Orde Nol, jika laju reaksinya tidak dipengaruhi oleh konsentrasi pereaksi. b. Reaksi Orde Satu, apabila besar laju reaksinya berbanding lurus dengan besarnya konsentrasi pereaksi. c. Reaksi Orde.

Persamaan laju reaksi orde reaksi Kimia SMA YouTube
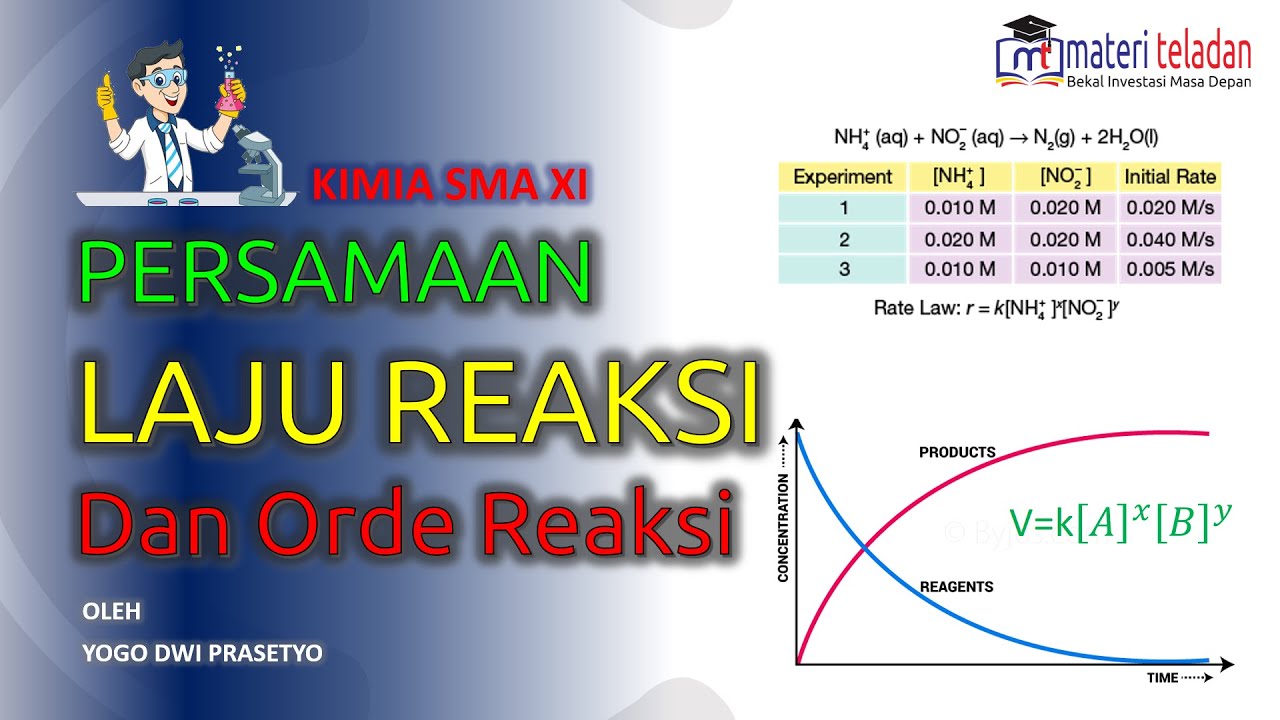
Secara umum untuk reaksi. aA + bB → cC + dD. Persamaan lajunya dapat dinyatakan dengan: r = k [A] x [B] y. Dimana k merupakan konstanta laju reaksi, x dan y merupakan merupakan orde dari A dan B yang harus ditentukan melalui data eksperimen. Jumlah dari orde A dan B (x + y) disebut sebagai orde reaksi.

Laju Reaksi Kimia Part3 [Persamaan Laju Reaksi & Orde Reaksi] 1x Nonton Pasti Paham
Orde-orde Reaksi. 1. Orde reaksi 0. Laju reaksi tidak bergantung pada konsentrasi. Persamaan reaksi yang berorde 0 yaitu v = k [A]0. 2. Orde reaksi 1. Laju reaksi berbanding lurus dengan konsentrasi pereaksi. Jika konsentrasi dinaikkan dua kali, maka laju reaksinya pun akan dua kali lebih cepat dari semula, dst.