
Koefisien reaksi atau nilai a, b, c, dan d dari persamaan...
1 pt. Antasida atau obat mag mengandung senyawa magnesium hidroksida dan aluminium hidroksida yang diberikan secara oral untuk mengurai rasa perih akibat suasana lambung yang terlalu asam. Rumus molekul senyawa tersebut secara berurutan adalah.. Al (OH) 3 dan Mg (OH) 2. Al (OH) 3 dan Mn (OH) 2. Mg (OH) 2 dan Al (OH) 3. Ca (OH) 2 dan Mg (OH) 2.

Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi
Penerapan Reaksi Redoks dalam Kehidupan Sehari-Hari. Di awal artikel, gue sempet mention beberapa contoh, lalu bagaimana nih penerapan reaksi redoks dalam kehidupan sehari sehari. Nah, supaya elo gampang mengingat, gue udah buat daftar contohnya berikut ini: Pembakaran. Tahu nggak sih, oksigen yang ada di atmosfer bumi itu mengalami penurunan.

Diantara Persamaan Reaksi Berikut Yang Merupakan Reaksi Redoks Adalah Di Antara Persamaan
Perhatikan reaksi berikut! PbO(s) + H2(g) → Pb(s) + H2O(l) Semua pernyataan berikut mengenai reaksi redoks di atas adalah benar, kecuali. adalah oksidator. adalah reduktor. bilangan oksidasi dalam adalah +4. bilangan oksidasi adalah. mengalami reaksi oksidasi. Iklan.
Contoh Soal Dan Pembahasan Reaksi Redoks Dan Elektrokimia Berbagai Contoh
Reaksi redoks adalah reaksikimia yang menyebabkan adanya perubahan bilangan oksidasi pada suatu unsur, maupun molekul. Selain ditandai dengan perubahan bilangan oksidasi, Reaksi ini juga ditandai dengan penambahan atau pengurangan oksigen dalam suatu molekul. Reaksi redoks terjadi akibat adanya reaksi reduksi dan oksidasi. Reaksi Reduksi

Pernyataan yang benar tentang entalpi adalah
Pengertian Reaksi Redoks. Reaksi redoks adalah jenis reaksi kimia di mana terjadi pertukaran elektron antara atom atau molekul yang terlibat. Istilah "redoks" sendiri berasal dari singkatan "reduksi-oksidasi.". Reaksi redoks sangat penting dalam kimia dan berbagai aspek kehidupan sehari-hari.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10 Belajar Gratis di Rumah
CuO + 2HCl → CuCl 2 + H 2 O. Pernyataan yang benar mengenai reaksi di atas adalah.. A. bukan reaksi redoks. B. reaksi autoredoks. C. reaksi diporposionasi. D. mengalami reaksi reduksi. E. mengalami reaksi oksidasi. Kunci Jawaban : A. Demikian yang dapat kami bagikan mengenai latihan Soal Kimia Redoks Kelas 10 SMA MA dan kunci jawaban.

Reaksi redoks berikut berlangsung dalam suasana asam.MnO4...
Adapun fungsi reaksi redoks dalam kehidupan sehari-hari, antara lain: - Untuk memahami fenomena korosi logam dan cara pencegahannya. - Penggunaan lumpur aktif untuk mengolah limbah. - Mengetahui reaksi fotosintesis. - Oksidasi makanan dalam sel. - Mur dan baut diberi lapisan zinc, di mana dalam lapisan itu terdapat proses oksidasi logam zinc.

Perhatikan reaksi redoks dan pernyataan berikut.2Br2+4NaO...
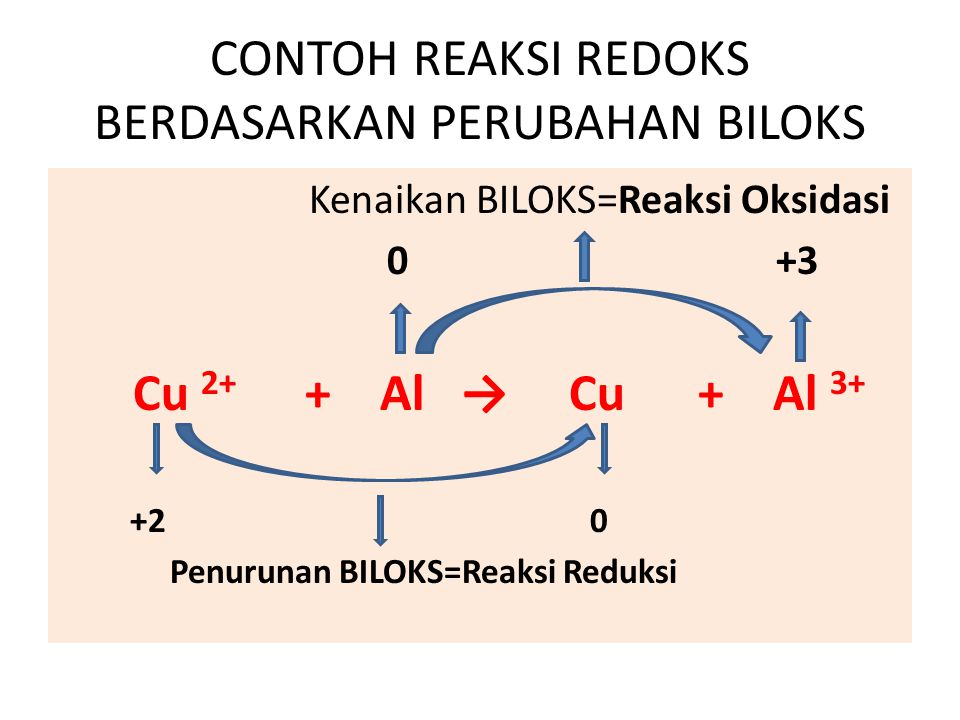
Jadi, yang merupakan reaksi oksidasi adalah FeO (biloks Fe mengalami kenaikan dari +2 menjadi +3) Dan yang mengalami reaksi reduksi adalah O 2 (biloks O menurun dari 0 menjadi -2). Konsep dan pemahaman reaksi redoks itu sendiri, secara umum memakai konsep kenaikan dan penurunan bilangan oksidasi.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Konsep Reaksi Redoks
Pertanyaan. Pernyataan yang benar mengenai reaksi redoks: MnO2 + 2H2SO4 + 2Nal → MnSO4 + Na2SO4 + 2H2O + I2. adalah. NaI merupakan oksidator. merupakan reduktor. merupakan hasil reduksi. merupakan hasil oksidasi. Atom I mengalami penurunan biloks.

Pernyataan yang kurang tepat tentang reaksi redoks adalah.... YouTube
Pertanyaan. Pernyataan yang benar mengenai reaksi reduksi dan oksidasi adalah.. reaksi oksidasi adalah reaksi yang melepaskan oksigen. reaksi reduksi adalah reaksi yang menangkap oksigen. reaksi oksidasi adalah reaksi yang melepaskan elektron. reaksi reduksi adalah reaksi yang melepaskan elektron. reaksi reduksi adalah reaksi pengurangan.

Pengertian Reaksi Redoks dalam Pembelajaran, Ini Penjelasannya
Dalam banyak situasi, reaksi oksidasi dan reduksi terjadi secara bersamaan, membentuk apa yang disebut sebagai reaksi redoks. Contoh klasik dari reaksi redoks adalah reaksi antara logam dan non-logam, seperti pembakaran logam alkali seperti natrium Na dalam udara: 4 N a + O 2 → 2 N a 2 O 4Na + O_2 \rightarrow 2Na_2O

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Perhatikan reaksi redoks berikut! Cr2O3+KClO3 +4KOH→2K2CrO4+KCl+2H2O. Pernyataan yang benar mengenai reaksi tersebut adalah . . . . mengalami reduksi. KOH merupakan reduktor. KCl merupakan hasil reduksi. merupakan hasil oksidasi. Bilangan oksidasi atom Cl dalam adalah +3. Iklan.

Penyetaraan reaksi redoks metode setengah reaksi suasana asam YouTube
Redoks. Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia . Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH 4 ), ataupun ia dapat berupa proses yang.

Diantara reaksireaksi dibawah ini yang merupakan reaksi redoks adalah . . . a. AgNO3 (aq
Pertanyaan. Di antara pernyataan berikut yang benar tentang reaksi redoks adalah . . . . Oksidator adalah zat yang teroksidasi. Reaksi reduksi melibatkan pelepasan elektron. Reaksi reduksi merupakan reaksi pengikatan oksigen. Reduktor adalah zat yang mengakibatkan zat lain tereduksi. Reaksi oksidasi melibatkan penurunan bilangan oksidasi. Iklan.

Reaksi berikut yang menunjukkan reaksi redoks adalah....
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.