
Pengertian,Sifat Dan Contoh Dari Senyawa Ion KIMIA OKE PINTAR
Peristiwa serah terima elektron berlangsung pada pembentukan senyawa - 12918070. andreptasetyo4749 andreptasetyo4749 27.10.2017 Kimia Sekolah Menengah Pertama terjawab • terverifikasi oleh ahli Peristiwa serah terima elektron berlangsung pada pembentukan senyawa 1 Lihat jawaban. Pembentukan senyawa ion Contohnya apa? Iklan Iklan.

[RANGKUMAN DAN MATERI LENGKAP] Partikel Penyusun Benda dan Makhluk Hidup (Sifat Bahan) GURU
Pengertian Ikatan ION. Ikatan ION merupakan ikatan yang terbentuk akibat dari serah terima elektron sehingga membentuk ion positif dan ion negatif yang wujud elektronnya sama seperti gas mulia. Gaya elektrostatik dapat mengikat ion positif dan ion negatif. Senyawa yang diproduksi dapat disebut dengan senyawa ion.
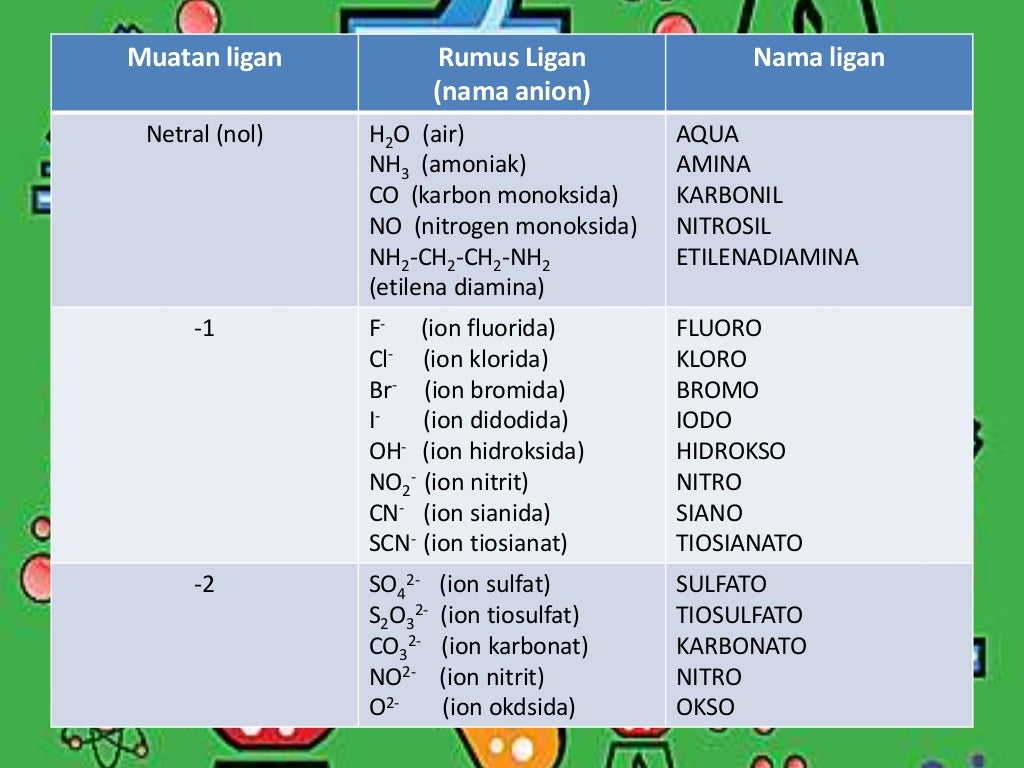
Presentasi kimia ion dan senyawa kompleks
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Peristiwa perpindahan el.

Tuliskan Rumus Elektron Rumus Lewis Dan Rumus Empiris Senyawa Yang My XXX Hot Girl
Halo Ko Friends pada soal kali ini kita diminta untuk menjelaskan manakah peristiwa pembentukan senyawa yang melibatkan adanya perpindahan elektron proses pembentukan senyawa yang melibatkan adanya perpindahan elektron terjadi ketika unsur-unsur pembentuk senyawa mengalami proses serah terima elektron atau pelepasan dan penangkapan elektron dari proses serah terima elektron inilah unsur-unsur.

Gambar berikut menunjukkan susunan elektron pada senyawa
Baca baik-baik ya! —. 1. Pengertian. Ikatan ion terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia. Ion positif dan ion negatif diikat oleh suatu gaya elektrostatik. Senyawa yang dihasilkan disebut senyawa ion.

Pembentukan Senyawa Ion Magnesium Klorida (MgCl2) dan Lambang Lewisnya YouTube
Pengertian Ikatan Ion. Ikatan ion adalah ikatan yang terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia. Ion positif dan ion negatif diikat oleh suatu gaya elektrostatik. Senyawa yang dihasilkan disebut senyawa ion.

Redoks berdasarkan kaidah serah terima elektron dari reak...
Proses Pembentukan Ikatan Ion. Setiap unsur harus berupaya buat memiliki konfigurasi elektron seperti gas mulia, bisa dengan cara melepaskan elektron atau menerima elektron agar stabil. Peristiwa serah terima elektron satu ini, bisa berlangsung terhadap senyawa NaCl alias garam dapur. Keterangannya:

Reaksi Dalam Total Sintesis Senyawa Organik
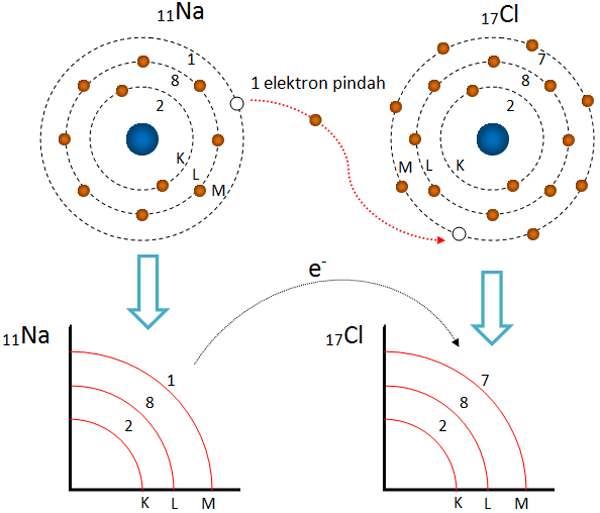
Peristiwa serah terima elektron ini berlangsung pada senyawa NaCl alias garam dapur. Na merupakan golongan IA dimana ia mempunyai elektron valensi 1, maka agar stabil ia harus melepas 1 elektron. Apabila dilihat dari konfigurasi elektronnya, 11Na: 2, 8, 1.

Contoh Senyawa Ion Dan Senyawa Kovalen Polar Merupakan senyawa ion atau kovalen polar. lursdert
Hai Yepa, kakak bantu jawab pertanyaanmu ya. Jawaban: Senyawa kimia dapat terbentuk karena serah terima elektron dari unsur-unsur pembentuknya dikemukakan oleh Gilbert N. Lewis. Teori ikatan Lewis menyatakan bahwa ada dua cara pembentukan ikatan dengan menggunakan elektron. Ikatan kimia yang pertama yaitu dengan serah terima elektron membentuk.
√ Ikatan Kimia (Ikatan Ion, Ikatan Logam, Ikatan Kovalen) Blog Ilmu Pengetahuan
Kestabilan unsur bisa diperoleh melalui peristiwa serah terima elektron saat berlangsung ikatan ion. Unsur yang bisa bereaksi membentuk ikatan ion dengan unsur B bernomor atom 15 adalah.. 1 unsur A bernomor atom 12; 2 unsur A bernomor atom 12; 1 unsur C bernomor atom 16; 2 unsur C bernomor atom 16; 3 unsur A bernomor atom 12; Pembahasan:

LENGKAP ‼️ PEMBENTUKAN SENYAWA ION DARI KATION DAN ANION ‼️ KIMIA KELAS 10 YouTube
Jadi,ikatan pada senyawa NaF merupakan ikatan Ionik ya. Terjadi perpindahan elektron valensi Na ke F untuk membentuk senyawa yang stabil (sumber gambar: wikipedia). Sehingga, terjadi serah terima elektron seperti pada contoh di atas. Nah, itu tadi tentang ikatan ionik. Semoga penjelasan di atas bisa menjawab pertanyaan elo jika.
Peristiwa Serah Terima Elektron Berlangsung Pada Pembentukan Senyawa
Satu elektron 3s pada natrium akan dipindahkan ke orbital 3p pada klorin. Peristiwa serah-terima elektron terjadi dalam proses pembentukan senyawa NaCl. Ini merupakan contoh dari ikatan ionik, yaitu ikatan kimia (gaya tarik-menarik yang kuat yang tetap menyatukan dua unsur kimia) yang berasal dari gaya tarik elektrostatik (gaya tarik-menarik.
PPT IKATAN KIMIA PowerPoint Presentation, free download ID5631507
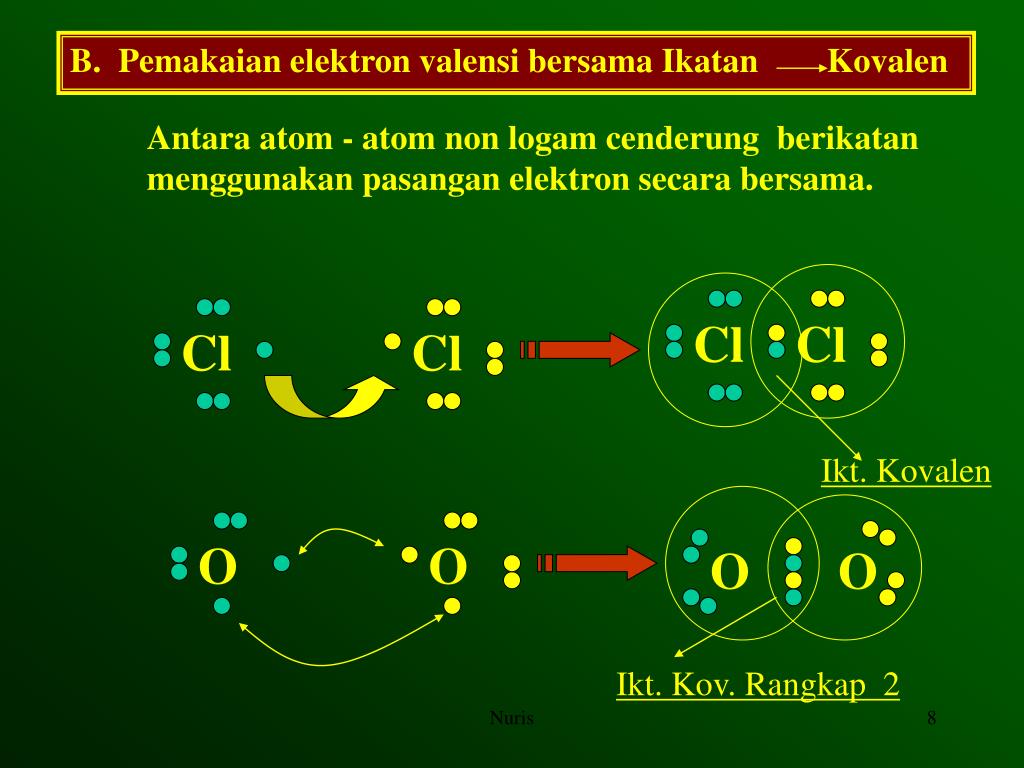
Jadi,ikatan pada senyawa NaF merupakan ikatan Ionik ya. Ikatan ionik hanya dapat terjadi antar unsur-unsur yang memiliki perbedaan keelektronegatifan cukup besar. Sehingga, terjadi serah terima elektron seperti pada contoh di atas. 2. Ikatan Kovalen. Ikatan kovalen terjadi ketika ada pemakaian elektron ikatan secara bersama.

Ikatan yang terjadi karena adanya serah terima elektron d...
Berdasarkan konsep serah terima elektron, reaksi redoks merupakan reaksi yang berlangsung melalui mekanisme serah terima elektron. Perhatikan reaksi berikut. Berdasarkan konsep reaksi redoks merupakan penggabungan dan pelepasan oksigen, maka pada reaksi (1) natrium mengalami oksidasi. Jika kalian perhatikan, reaksi (2) antara natrium dan klorin.

Gambarkan Struktur Lewis Untuk Senyawa Na2O bukubelajarstate
Jadi, peristiwa perpindahan elektron terjadi pada proses pembentukan . Jadi, jawaban yang tepat adalah B. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS!

Senyawa Ion dan Contoh Pembentukan Senyawa Ion Belajar IPA
Peristiwa serah terima elektron satu ini bisa berlangsung terhadap senyawa NaCl alias garam dapur.. Jika dilihat dari konfigurasi elektronnya, maka 11Na: 2, 8, 1. Sehingga pada saat terjadinya pelepasan 1 elektron, maka elektron yang paling terakhir akan menjadi 8 (sesuai kaidah oktet). Sebab melepas 1 elektron, maka Na yang.