
Manfaat Penurunan Titik Beku Ilmu Kimia
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Penurunan Titik Beku. Tekanan Osmotik. Sifat Koligatif yang Abnormal.. (K13R K12, Kumer Fase F) Pengertian Redoks dan Penentuan Biloks. Jenis Reaksi Redoks. Penyetaraan Metode Setengah Reaksi. Penyetaraan Metode Perubahan Bilangan Oksidasi. Ringkasan - Reaksi Redoks. Tes Evaluasi - Reaksi Redoks. Elektrokimia (K13R K12, Kumer Fase F)

PENURUNAN TITIK BEKU Ilmu Kimia
Penurunan titik beku termasuk salah satu sifat sifat koligatif larutan yang sering diterapkan dalam kehidupan sehari-hari. Yuk, baca ulasan lengkapnya di artikel ini!. / Pahami Pengertian Penurunan Titik Beku, Rumus, dan Contoh Soalnya. Pahami Pengertian Penurunan Titik Beku, Rumus, dan Contoh Soalnya. March 25, 2023 - 11:17 pm - 6 min read

Materi Penurunan Titik Beku Beserta Contoh Soal Dan Pembahasan Reverasite
Mengenal Rumus dan Contoh Soal Hukum Hess. ∆Tf = Tf (pelarut) - Tf (larutan) ∆Tf = m . Kf. Keterangan: ∆Tf = penurunan titik beku (freezing point depression) m = molalitas. Kf = tetapan penurunan titik beku (ºC kg/mol) Untuk mengaplikasikan rumus di atas, Anda bisa menyimak contoh soal di bawah ini agar meningkatkan pemahaman.

Penurunan Titik Beku Catatan Pak Rizal
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Contohnya termasuk penambahan garam dalam air, alkohol dalam air, atau pencampuran dua padatan seperti pengotor menjadi obat bubuk halus. Dalam kasus terakhir, senyawa yang ditambahkan adalah zat terlarut, dan padatan asli dianggap.

Diketahui data percobaan penurunan titik beku bebe...
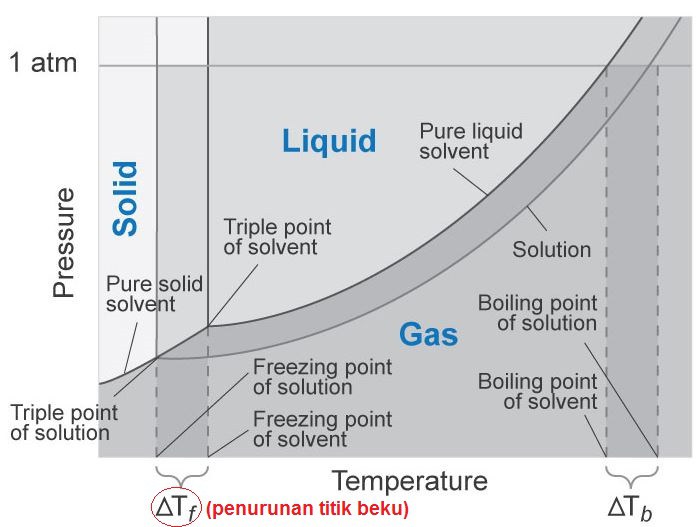
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.
PENURUNAN TITIK BEKU LARUTAN DAN APLIKASINYA
Pada dasarnya, pengertian penurunan titik beku memiliki beberapa kelebihan dan kelemahan yang perlu diperhatikan. Berikut adalah penjelasan lebih lanjut mengenai kedua aspek tersebut: Kelebihan. 1. Mewujudkan efisiensi dalam pembekuan: Dengan memahami penurunan titik beku, para ahli dapat mengoptimalkan proses pembekuan dalam industri makanan.

Data percobaan penurunan titik beku Larutan Konsentrasi
Tekanan yang Mempengaruhi Penurunan Titik Beku. Tekanan adalah salah satu faktor yang mempengaruhi titik beku suatu zat. Sebagai contoh, jika tekanan udara di suatu tempat menurun, maka titik beku air juga akan menurun. Hal ini dikarenakan ketika tekanan berkurang, molekul-molekul air memiliki energi kinetik yang lebih tinggi sehingga lebih.

Pengertian Titik Beku Pada Suhu Zat Cair LABORATORIUM SMK
ΔTf: penurunan titik beku m: molalitas larutan Kf: konstanta penurunan titik beku (°C kg/mol) Contoh aplikasi penurunan titik beku. Contoh aplikasi penurunan titik beku adalah dengan menaburkan garam di jalanan musim dingin. Pada musim dingin, uap air dan air mudah membeku membentuk lapisan es, sehingga jalanan sulit untuk dilewati. Penaburan.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Contoh larutan elektrolit adalah larutan garam, asam, dan basa. Rumus penurunan titik beku untuk larutan elektrolit adalah: T f = K f . m . i . Penerapan rumus penurunan titik beku dalam kehidupan sehari-hari. foto: freepik.com. Penurunan titik beku ini memiliki banyak penerapan dalam kehidupan sehari-hari, seperti: 1. Pembuatan es krim.

Pengertian Penurunan Titik Beku KIMFIS PDF
Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat. Adapun titik beku besarnya sama dengan titik lebur yakni 0°C. Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf. Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang ikut terlarut di dalamnya.

Contoh Sifat Koligatif Penurunan Titik Beku Reverasite
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Penurunan Titik beku YouTube
Seperti halnya titik didih, penurunan titik beku (ΔTf) berbanding lurus dengan kemolalan larutan : ΔTf ≈ m ΔTf = Penurunan titik beku Atau Kf =Tetapan kenaikan titik beku m = Molalitas ΔTf = Kf x m Tf = 0°C - ΔTf Kf disebut tetapan penurunan titik beku molal. Nilai Kf untuk benzena 5,12 °C m-1.

Praktikum Kimia Sederhana Penurunan Titik Beku 2 YouTube
Pengertian Penurunan Titik Beku. Membeku adalah perubahan fase dari zat cair menjadi zat padat karena penurunan suhu. Ketika suhu suatu zat cair mencapai titik beku atau di bawahnya, molekul-molekul atau partikel-partikel dalam zat tersebut mulai merapatkan diri ke dalam struktur kristal yang teratur. Proses ini menghasilkan solidifikasi zat.

Kenaikan Titik Didih & Penurunan Titik Beku Sifat Koligatif larutan Kimia Kelas XII YouTube
PENURUNAN TITIK BEKU Nina Fitriana*, Frista Irwaninda Lab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 2 Sekaran Gunungpati Semarang, Indonesia, 50225 [email protected], 085770440465 Abstrak Percobaan ini dilakukan untuk menentukan tetapan penurunan titik beku asam asetat dan menentukan massa molekul relatif.