
Massa Atom Relatif dan Isotop Konsep Dasar Atom 2 YouTube
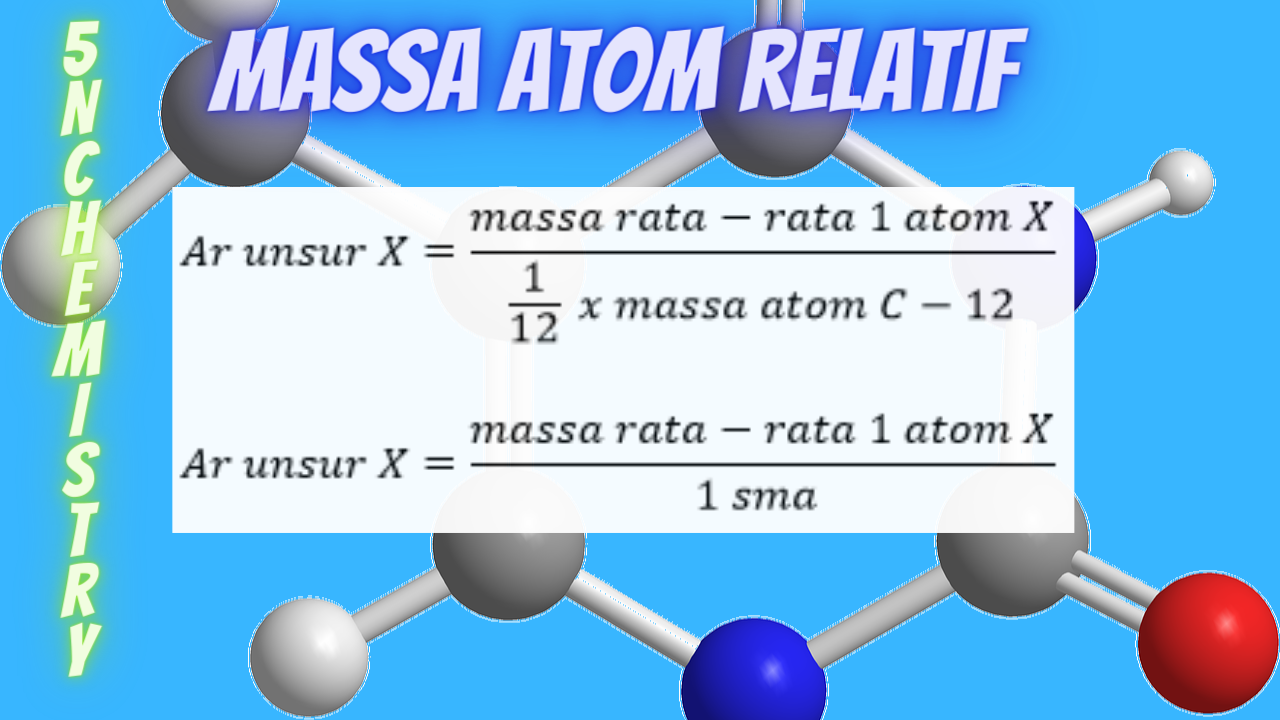
Massa Atom Relatif. Pengertian massa atom relati f atau Ar adalah bilangan yang menyatakan perbandingan massa rata - rata satu atom suatu unsur terhadap 1/12 massa satu atom karbon - 12. Pemilihan atom karbon berdasarkan pada kesepakatan internasional yang menetapkan bahwa massa isotop karbon - 12 memiliki massa tepat 12 sma (satuan massa.

38+ Soal Kimia Tentang Massa Atom Relatif Contoh Soal dan Jawaban
Yuk, belajar Massa Atom Relatif, Massa Molekul Relatif, Pengertian dan Perhitungan Mol, Rumus Kimia Senyawa, dan Contoh Soalnya. Yuk belajar sekarang!. Pengertian Massa Atom Relatif. Massa atom relatif secara sederhana merupakan massa yang dimiliki oleh sebuah unsur relatif jika dibandingkan dengan massa atom karbon (C-12).

MASSA ATOM RELATIF (Ar) DAN MASSA MOLEKUL RELATIF (Mr) YouTube
Massa Atom Relatif dan Massa Molekul Relatif. Cara membaca tabel periodik, sebuah hidrogen memiliki nomor atom 1 dan Ar (massa atom relatif) sebesar 1,008. (8thgradescienceleahbarnes4a.weebly.com) KOMPAS.com - Atom adalah suatu unsur murni yang tedriri dari inti atom dan juga elektron. Molekul adalah senyawa yang tersusun dari dua jenis atom.

Diketahui massa atom relatif (Ar) H=1, C=12, N=14, dan O=...
Massa atom relatif adalah perbandingan massa rata-rata unsur X terhadap 1/12 x massa atom C-12, yang dirumuskan. Contoh Soal No. 1: Massa rata-rata atom unsur X adalah 3×10-23 gr. Sedangkan massa 1 atom C-12 adalah 2×10-23 gr. Berapa massa atom relatif unsur X tersebut? Pembahasan: Diketahui: massa rata-rata X = 3×10-23 gr. massa atom C-12.
Cara Menentukan Massa Atom Relatif Unsur Rumus Contoh Soal Pengertian My XXX Hot Girl
Perhitungan Ar didasarkan pada unsur karbon-12 sebagai standar sedangkan perhitungan Mr didasarkan pada total Ar atom penyusunnya. Untuk mengetahui cara menentukan Ar atom dan Mr suatu molekul ataupun senyawa, simaklah pembahasan tiga soal dibawah ini!

Tabel Massa Atom Relatif
Massa atom (m a) dari suatu unsur kimia adalah massa suatu atom pada keadaan diam, umumnya dinyatakan dalam satuan massa atom. [1] Massa atom sering disinonimkan dengan massa atom relatif, massa atom rata-rata, dan bobot atom. Walaupun demikian, terdapat sedikit perbedaan karena nilai-nilai tersebut dapat berupa rata-rata berbobot dari massa.

MASSA ATOM RELATIF KIMIA SMA KELAS 10 YouTube
5 Hukum Dasar Kimia, Bunyi, Rumus, Contoh Soal dan Pembahasan 2. Para ahli kimia menggunakan isotop karbon C-12 sebagai standar dengan massa atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C-12. Atau dapat dituliskan sebagai berikut. 1 satuan massa atom (amu) =. 1.

Diketahui massa atom relatif (Ar) O=16, Al= 27 , dan S...
Sumber: Pixabay/andreas160578. Fungsi utama massa molekul relatif, yaitu untuk menghitung massa dari suatu molekul. Karena itu, massa molekul relatif hanya berlaku untuk zat-zat yang terdiri atas molekul saja. ADVERTISEMENT. Massa molekul relatif juga berfungsi untuk menentukan rumus molekul.

Massa Atom Relatif (Stoikiometri Kimia SBMPTN, SMA) YouTube
Maka dari itu, massa setiap molekul hidrogen akan sama dengan 0,0900/1,429 kali massa molekul oksigen. Pada waktu itu atom oksigen digunakan sebagai standar massa atom yaitu 16 s.m.a. Oleh karena itu, maka massa molekul oksigen (O 2) adalah 32 s.m.a. Berdasarkan hal tersebut, massa molekul hidrogen dapat dihitung sebagai berikut:

Part 1 PENTING!! BEDA NOMOR MASSA vs MASSA ATOM (massa atom relatif, massa atom ratarata),sma
Cara Menentukan Massa Atom Relatif. Atom unsur ditulis dengan cara satu huruf besar dan satu huruf kecil di belakangnya. Contohnyaa yaitu Cl, Br, H, Mn, B, dan O. Sedangkan molekul adalah gabungan dua buah unsur atau lebih yang sama. Dengan begitu, maka penulisannya ditambah angka di belakang unsurnya. Contoh molekul yaitu Cl2, P4, O2,H2, dan Br2.
.jpg)
Rumus Massa Atom Relatif (Ar) dan Cara Menghitungnya Kimia Kelas 10
Penjelasan dan Cara Menghitung Massa Atom Relatif.. Baca Juga: Ciri Khas Atom Karbon, Pengertian, Jenis Ikatan dan Bentuk Rantai. Berbeda lagi jika atom mempunyai tiga isotop, maka ketiganya juga harus kita hitung. Misalnya adalah unsur neon yang mempunyai 3 isotop, neon -20, neon-21, serta neon-22. Diketahui juga jika kelimpahan neon-20 di.

Bahan Ajar Massa Atom Relatif dan Massa Molekul Relatif Kimia Dasar UPI Studocu
Di alam, suatu unsur bisa memiliki lebih dari satu isotop sehingga massa atom relatif berfungsi sebagai nilai rata-rata dari setiap massa isotop. Untuk menghitung massa atom relatif dari unsur yang memiliki lebih dari satu isotop adalah sebagai berikut. Ar X = (% kelimpahan X1 . Ar X1) + (% kelimpahan X2. Ar X2) + dst100 %.

MASSA ATOM RELATIF (Ar) DAN MASSA MOLEKUL RELATIF YouTube
Massa atom standar memperhitungkan penyebaran isotopik dari unsur pada sampel yang diberikan (biasanya diasumsikan "normal"). Sebagai contoh, air memiliki massa molar 18.0153 (3) g/mol, namun molekul air sendiri memiliki massa molekul dengan rentang antara 18.010 564 6863 (15) u ( 1 H 216 O) dan 22.027 7364 (9) u ( 2 H 218 O).

3 Modi per Calcolare la Massa Atomica wikiHow
Sekarang, kita lanjut lagi, ya! Kalau kamu perhatikan rumus Ar tadi, untuk menghitung Ar atau massa atom relatif, kita harus menghitung massa rata-rata dari 1 atom unsur yang mau kita hitung. Kenapa kita harus menentukan massa atom rata-rata dari setiap unsur? Jadi, atom-atom unsur yang sama, tidak selalu mempunyai massa yang sama. Kita bisa menganalogikannya

Massa atom relatif (Ar) dan Massa molekul relatif (Mr) penjelasan materi KIMIA kelas X
Sementara nomor massa adalah jumlah proton dan neutron dalam suatu atom, nomor atom hanyalah jumlah proton. Nomor atom adalah nilai yang ditemukan terkait dengan suatu unsur pada tabel periodik karena merupakan kunci identitas unsur. Satu-satunya saat nomor atom dan nomor massa sama adalah ketika Anda berurusan dengan isotop hidrogen protium.

LKPD massa atom relatif (Ar) dan massa molekul relatif (Mr) Belajar Bersama
Sebaiknya Anda harus tahu. Pengertian nomor massa tidak sama dengan massa atom. Nomor massa adalah bilangan yang merupakan jumlah proton dan neutron dalam satu atom. Jadi, nomor massa selalu merupakan bilangan bulat dan tanpa satuan. Sedangkan massa atom adalah bilangan yang menyatakan massa satu atom. Biasanya massa atom dinyatakan dalam satuan massa atom (sma).