
Teori Asam Basa
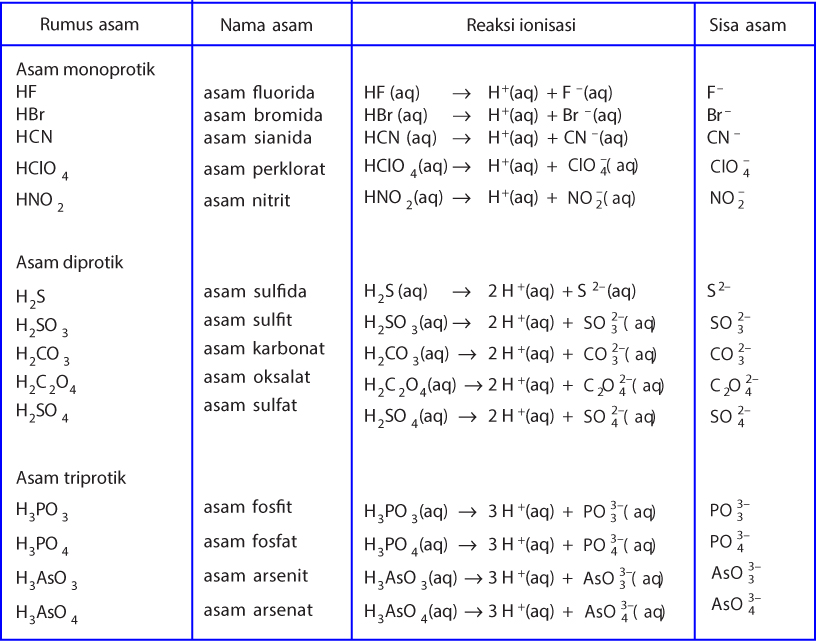
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).
Pengertian Asam dan Basa Menurut BronstedLowr
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).

Teori Asam Basa Bronsted Lowry
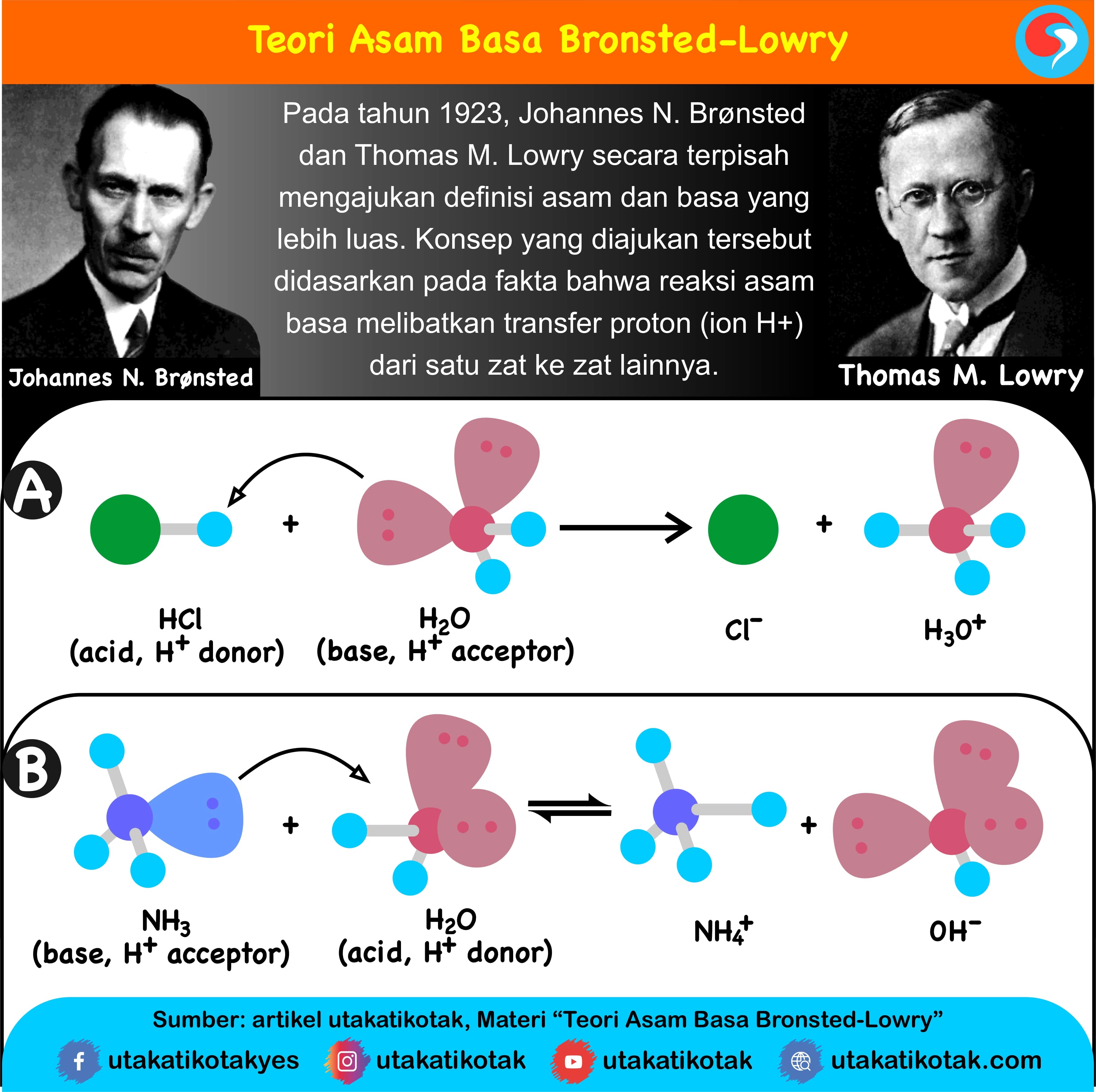
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Menentukan Asam Basa Konjugat BronstedLowry YouTube
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Asam klorida akan melepaskan ion H+, sehingga membentuk ion klorida (Cl-) dan meninggalkan ion H3O+ (hidronium) dalam air. Jadi, dalam reaksi ini, asam klorida bertindak sebagai donor proton, sehingga diklasifikasikan sebagai asam menurut konsep Bronsted-Lowry. Pengertian Basa Menurut Bronsted-Lowry

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Pengertian basa menurut teori asam basa bronsted-lowry adalah zat atau spesi (ion/molekul) yang menjadi penerima proton (akseptor H+ atau penerima hidrogen). Teori Bronsted-Lowry bisa digunakan saat menjelaskan sifat dari asam basa dengan menggunakan berbagai macam pelarut, tidak hanya air (H2O). Jadi bisa dituliskan bahwa: Asam = donor H+ Basa.

Teori Asam Basa Bronsted Lowry YouTube
Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.; Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa Bronsted-Lowry dapat menjelaskan sifat asam dari NH 4 Cl. Dalam NH 4 Cl, yang bersifat asam adalah ion NH 4 + karena.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Dalam teorinya, Bronsted dan Lowry menjawab kekuranngan yang ada dalam teori Arrhenius yang tidak dapat menyimpulkan senyawa asam basa yang reaksinya tidak membentuk larutan. Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang.

Sintético 104+ Foto Acidos Y Bases De Bronsted Lowry Lleno
Terdapat beberapa karakteristik khas yang membedakan asam dan basa menurut teori Bronsted-Lowry: 1. Asam: - Asam dapat melepaskan ion H+. - Asam bersifat korosif dan dapat menyebabkan iritasi pada kulit. - Contoh asam umum meliputi asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). 2.

Cara Mencari Pasangan Asam Basa Menurut Teori Bronsted Lowry AsamBasa YouTube
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Pengertian Asam Basa Teori Asam Basa - Lewi, Sarrhenius, Bronsted Lowry [LENGKAP] Asam dan basa adalah dua kelas bahan kimia yang sangat umum di lingkungan kita. Sebagai contoh, cuka, asam sitrat dan asam lambung diklasifikasikan sebagai asam, sedangkan kapur sirih dan soda kaustik diklasifikasikan sebagai alkali.. Menurut Bronsted-Lowry.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Menurut Teori Bronsted Lowry, asam adalah substansi yang mampu menyumbangkan atau melepaskan ion H+ (proton), sedangkan basa adalah substansi yang mampu menerima ion H+. Dengan kata lain, dalam reaksi kimia, asam akan melepaskan proton dan basa akan menerima proton. Contoh paling sederhana dari reaksi ini adalah reaksi antara asam klorida (HCl.

Perhatikan persamaan reaksi asam basa menurut BronstedLo...
Pengertian Asam Basa Brønsted-Lowry. Menurut teori asam basa Brønsted-Lowry, asam adalah donor atau penyumbang proton, dan basa adalah akseptor atau penerima proton. Pengertian ini sebenarnya agak menyesatkan, karena lebih tepat merupakan kompetisi proton antara dua senyawa dengan pemenangnya adalah basa. Teori ini tidak menekankan tingkah.