2 Cara Menentukan Bentuk Molekul Suatu Senyawa Materi Kimia
Kalau ikatan kovalen nonpolar, pasangan elektron ikatannya akan sama kuat ke semua atom, di mana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak. Nah, itu dia jenis-jenis ikatan kovalen.

Bentuk molekul/ part 1/ dengan teori tolakan pasangan elektron YouTube
Pasangan elektron bebas (PEB) mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan. Hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom, sehingga gerakannya lebih leluasa. Urutan kekuatan tolak-menolak diantara pasangan elektron adalah sebagai berikut.

Cara Menentukan Jumlah Pasangan Elektron Pada Konfigurasi Subkulit YouTube
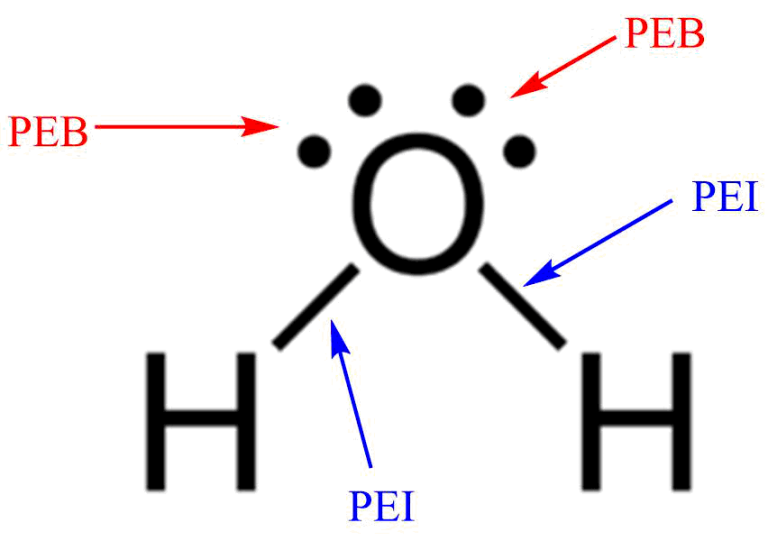
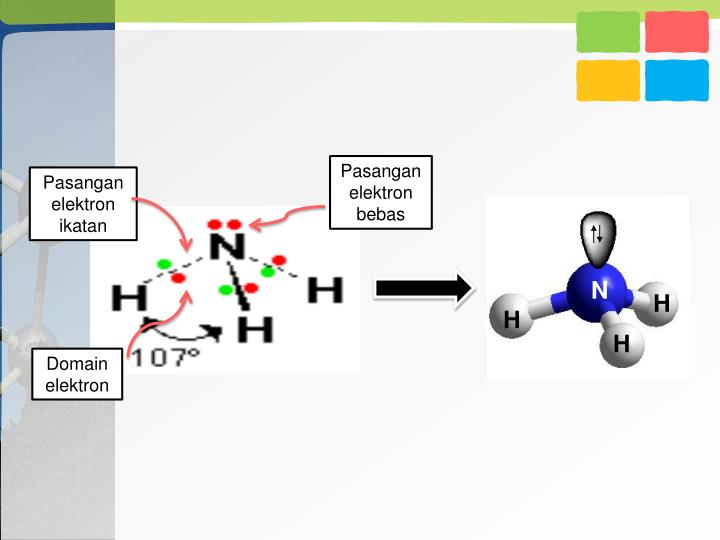
Dalam molekul NH 3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). 2. Struktur Lewis Molekul H 2 O. Atom 8 O memiliki konfigurasi elektron 8 O:2, 6.

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Ikatan kovalen. Ikatan kovalen adalah sejenis ikatan kimia yang memiliki karakteristik berupa pasangan elektron yang saling terbagi (pemakaian bersama elektron) di antara atom-atom yang berikatan. Singkatnya, stabilitas tarikan dan tolakan yang terbentuk di antara atom-atom ketika mempergunakan bersama elektron dikenal sebagai ikatan kovalen.
PPT Geometri Molekul dan Gaya Antarmolekul PowerPoint Presentation ID3454498
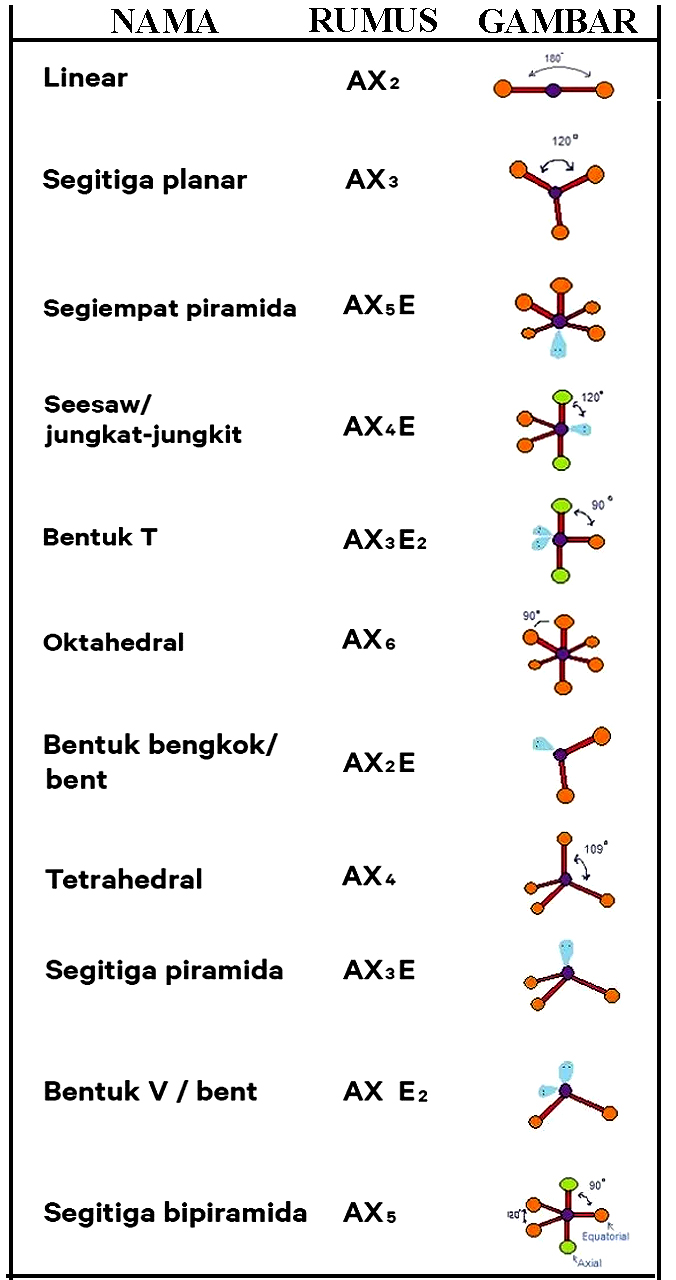
Teori VSEPR. Menurut teori VSEPR (Valence Shell Electron Pair Repulsion) yang berbunyi "pasangan-pasangan elektron akan berusaha saling menjauhi sehingga tolak-menolak antara pasangan elektron menjadi minimum" . bentuk molekul dapat diramalkan dari jumlah pasangan elektron valensi atom pusat, dan juga posisi pasangan elektron tersebut dalam atom pusat.

Berdasarkan analisis jumlah pasangan elektron ikatan (PEI...
Di dalam ikatan ini, atom yang berkongsi pasangan elektron dari dirinya sendiri dikenali sebagai penderma elektron. Atom yang lain yang menerima pasangan elektron dikenali sebagai penerima. Selepas proses perkongsian elektron, setiap atom akan mencapai kestabilan. Jenis ikatan ini adalah berpandukan teori Lewis. Rujukan: Akash Byjus (2021).

Berdasarkan analisis jumlah pasangan elektron ikatan ( PEI ) dan pasangan elektron bebas ( PEB
Teori Tolakan Pasangan Elektron Kulit Valensi tidak selalu memprediksi geometri molekul yang benar. Contoh pengecualian meliputi: molekul logam transisi (misalnya, CrO 3 adalah trigonal bipiramidal, TiCl 4 adalah tetrahedral) molekul elektron ganjil (CH 3 adalah planar daripada piramida trigonal)
Tentukan jumlah pasangan elektron terikat, jumlah
Teori Bentuk Molekul. 1. Teori VSEPR. Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron "mandiri") saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
Apabila pasangan elektron hanya berasal dari salah satu atom yang berikatan maka ikatan yang terbentuk ikatan kovalen koordinasi, demikian seperti dikutip modul Kimia. Sementara itu, untuk menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron (struktur Lewis). Yang mana, rumus ini menggambarkan bagaimana peranan.
Suatu molekul mempunyai 5 pasangan elektron di sek...
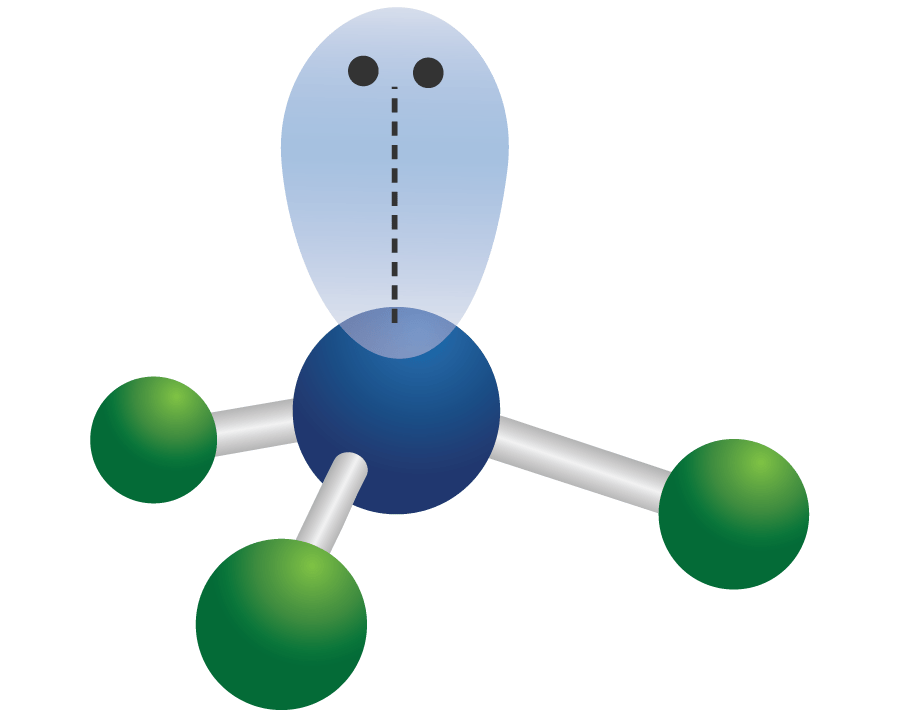
Menentukan jumlah pasangan elektron bebas (PEB) atom pusat molekul atau ion poliatom merupakan hal penting ketika ingin memprediksi geometri pasangan elektron dan geometri (bentuk) molekul atau ion poliatom. Dalam sistem AXE atau VSEPR dan juga teori domain elektron keberadaan PEB sangat menentukan bentuk molekul atau bentuk ion poliatom.
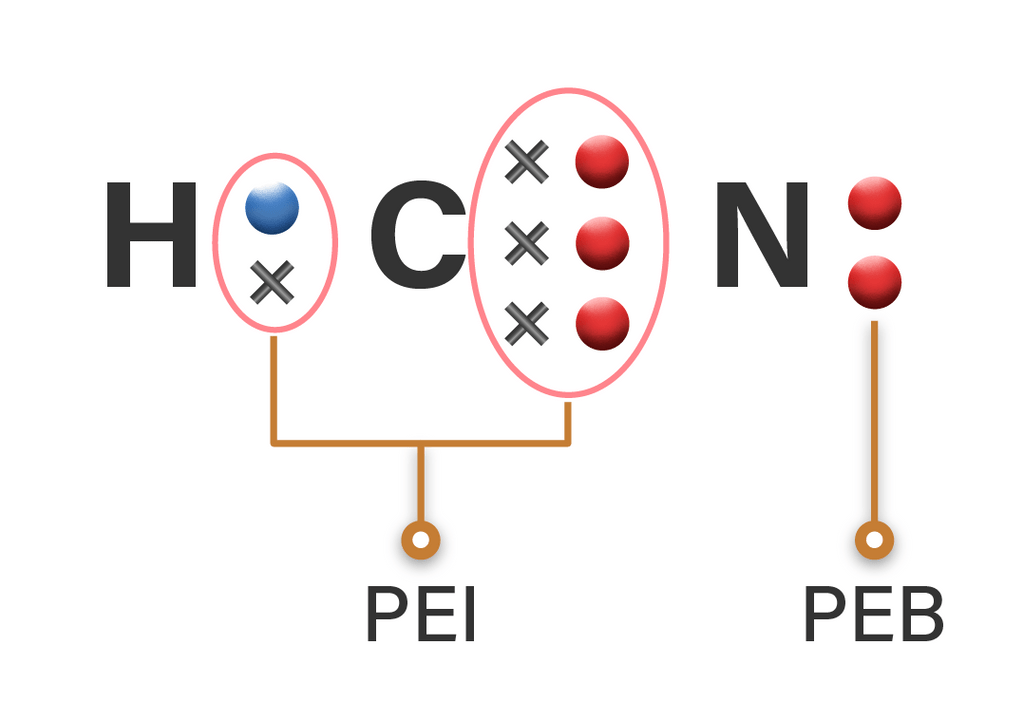
Berapa jumlah pasangan elektron ikatan dan pasanga...
Gambar di atas merupakan struktur lewis CH4 yang merupakan senyawa metana. Terlihat pada gambar, atom pusat C memiliki empat pasangan elektron ikatan (PEI) dan tidak memiliki pasangan elektron bebas (PEB). Maka tipe molekulnya yaitu AX4. Demikian pembahasan terkait struktur lewis dalam ikatan kovalen yang perlu diketahui. Semoga bermanfaat ya.

PASANGAN ELEKTRON (PEI DAN PEB) YouTube
Pada ikatan kovalen, setiap elektron dalam pasangan elektron yang digunakan bersama ditarik oleh inti dari kedua atom non logam. Advertisement. Gaya tarikan elektron ke inti inilah yang mengikat dua atom tersebut sehingga terbentuklah ikatan kovalen, seperti Cl2, H2, I2, O2, dan sebagainya.

KONFIGURASI ELEKTRON MENURUT TEORI ATOM BOHR & ELEKTRON VALENSI (KIMIA SMA KELAS 10) YouTube
Dari 8 elektron (4 pasang elektron) tersebut, keempatnya merupakan PEI (Pasangan Elektron Ikatan) dengan 1 elekton atom C berikatan dengan 1 elektron atom H. Berdasarkan data pada tabel, kita dapat menyimpulkan bahwa molekul CH$_4$ dengan notasi VSEPR AX$_4$, memiliki bentuk molekul tetrahedron (tetrahedral).
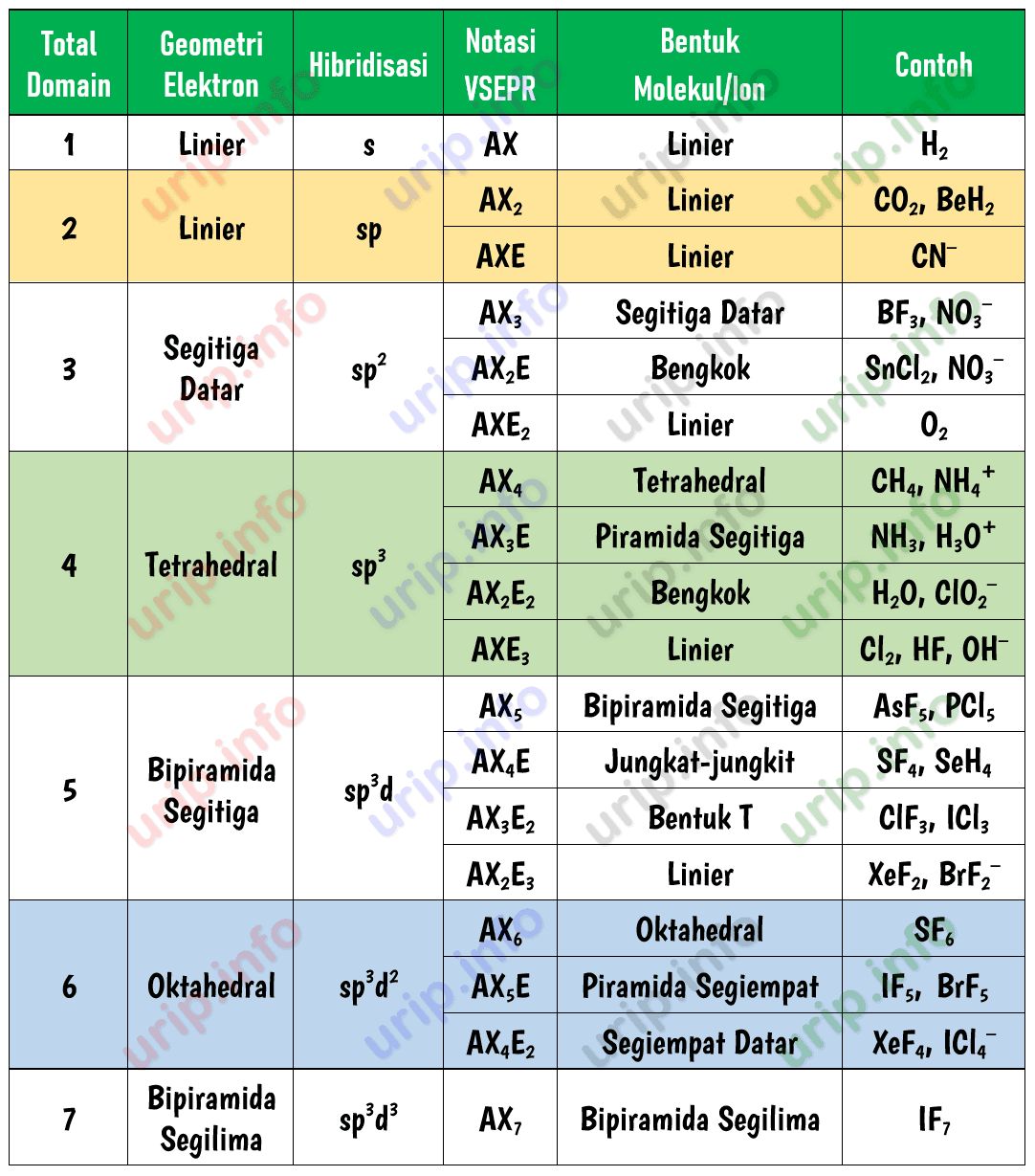
Cara Praktis Menghitung Jumlah Pasangan Elektron Bebas Atom Pusat dalam Molekul atau Ion
Jumlah pasangan elektron bebas (PEB) dapat dihitung dengan cara mengurangi pasangan elektron atom (PE) dengan pasangan elektron ikatan (PEI). Bilangan sterik. Dilansir dari Lumen Learning, jumlah a dan x disebut dengan bilangan sterik yang dikaitkan dengan jumlah total orbital hibridisasi yang digunakan oleh teori ikatan valensi.

Pasangan atom berikut yang mempunyai elektron valensi sama banyak adalah YouTube
Tidak terdapat pasangan elektron bebas, seperti CCl 4, PCl 5, dan SF 6. Senyawa CH 4 atau metana juga termasuk salah satu ikatan kovalen non polar. Senyawa ini memiliki bentuk yang simetris, artinya tidak ada pasangan elektron bebas pada struktur molekul lewisnya. Selain itu, selisih nilai keelektronegatifan atom C dan atom H juga kurang dari 0,5.
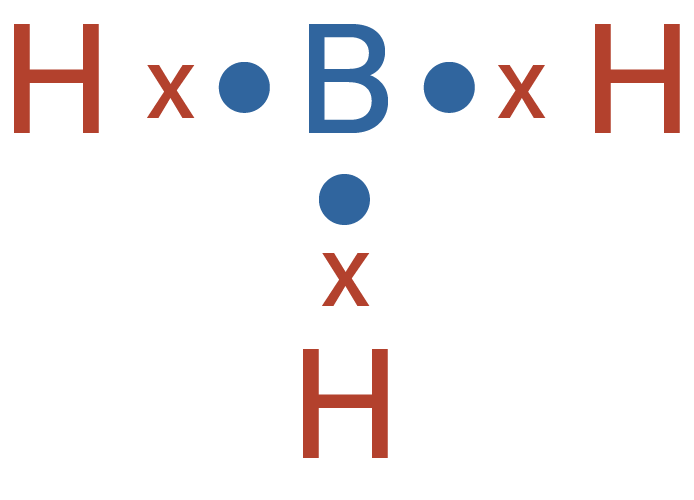
Tentukan jumlah pasangan elektron terikat, jumlah
Teori VSEPR ( Valence Shell Electron Pair Repulsion: "tolakan pasangan kulit elektron valensi") adalah suatu model kimia yang digunakan untuk menjelaskan bentuk-bentuk molekul kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron. [1] Teori ini juga dinamakan teori Gillespie - Nyholm, dinamai atas dua orang pengembang teori ini.