
Manakah dari spesi berikut dapat bertindak sebagai asam d...
Spesi seperti ini disebut ampiprotik. Reaksi antara ion HCO3- dan HF serta reaksi antara ion HCO3- dan ion OH-, persamaan kimianya: Pada reaksi pertama, ion HCO3- menerima proton dari HF maka ion HCO3- bertindak sebagai basa.Pada reaksi kedua, HCO3- memberikan proton kepada ion OH- maka ion HCO3- bertindak sebagai asam.

Peran Sentral Konsep AsamBasa dalam Reaksi Kimia Organik
Larutan tersebut bisa mengalami disosiasi total dalam larutan. Sementara basa kuat adalah senyawa basa yang bila dilarutkan dalam air akan melepaskan ion OH - dengan mudah. Sementara itu, asam kuat + basa kuat = netral. Artinya apabila reaksi asam kuat dicampurkan dengan basa kuat akan menghasilkan larutan dengan pH 7 atau netral. Asam basa lemah

Teori Asam Basa
Pada dasarnya reaksi redoks berlangsung di dalam pelarut air sehingga penyetaraan persamaan reaksi redoks selalu melibatkan ion H+ dan OH-. Terdapat dua metode untuk menyetarakan reaksi redoks, yaitu dengan cara bilangan oksidasi dan cara setengah reaksi (Vinsiah, 2020).
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Reaksi Asam-Basa. Misalnya, ketika asam klorida, HCl, dan natrium hidroksida , NaOH, dicampur, H + bereaksi dengan OH - untuk membentuk air: H + (aq) + OH - (aq) → H 2 O. HCl bertindak sebagai asam dengan menyumbangkan ion H + atau proton dan NaOH bertindak sebagai basa, memberikan ion OH - .

tunjukkan mana yang bertindak sebagai asam dan basa Lewis pada reaksi berikut Brainly.co.id
Di dalam cairan lambung ini, yang bertindak sebagai larutan penyangga ternyata sangat kompleks, lho. Salah satu contohnya adalah campuran ion bikarbonat (HCO 3 -) dan ion karbonat (CO 3 2-). Campuran ini dapat mencegah perubahan pH yang drastis pada lambung, sehingga mencegah kerusakan lambung akibat pH makanan yang berubah-ubah. Misalkan.

tunjukkan mana yang bertindak sebagai asam dan basa Lewis pada reaksi berikut Brainly.co.id
Pencemaran air terjadi karena adanya material atau bahan-bahan yang berasal dari kegiatan manusia, baik material organik dan anorganik yang sifatnya beracun atau tidak beracun, yang secara.
Teori Asam Basa Lewis KIMIA OKE PINTAR
Contoh senyawa amfoter yang paling dekat dengan manusia adalah air (H2O). Air dapat bertindak sebagai basa dengan menerima proton saat bereaksi dengan asam.. chem.libretexts.org Reaksi air dengan HCL di mana air bertindak sebagai basa dan reaksi air dengan NH3 di mana air. Jawaban dari Soal "Persamaan Lingkaran yang Berpusat Pada Titik (4.

Reaksi Asam Basa Read HSTKB
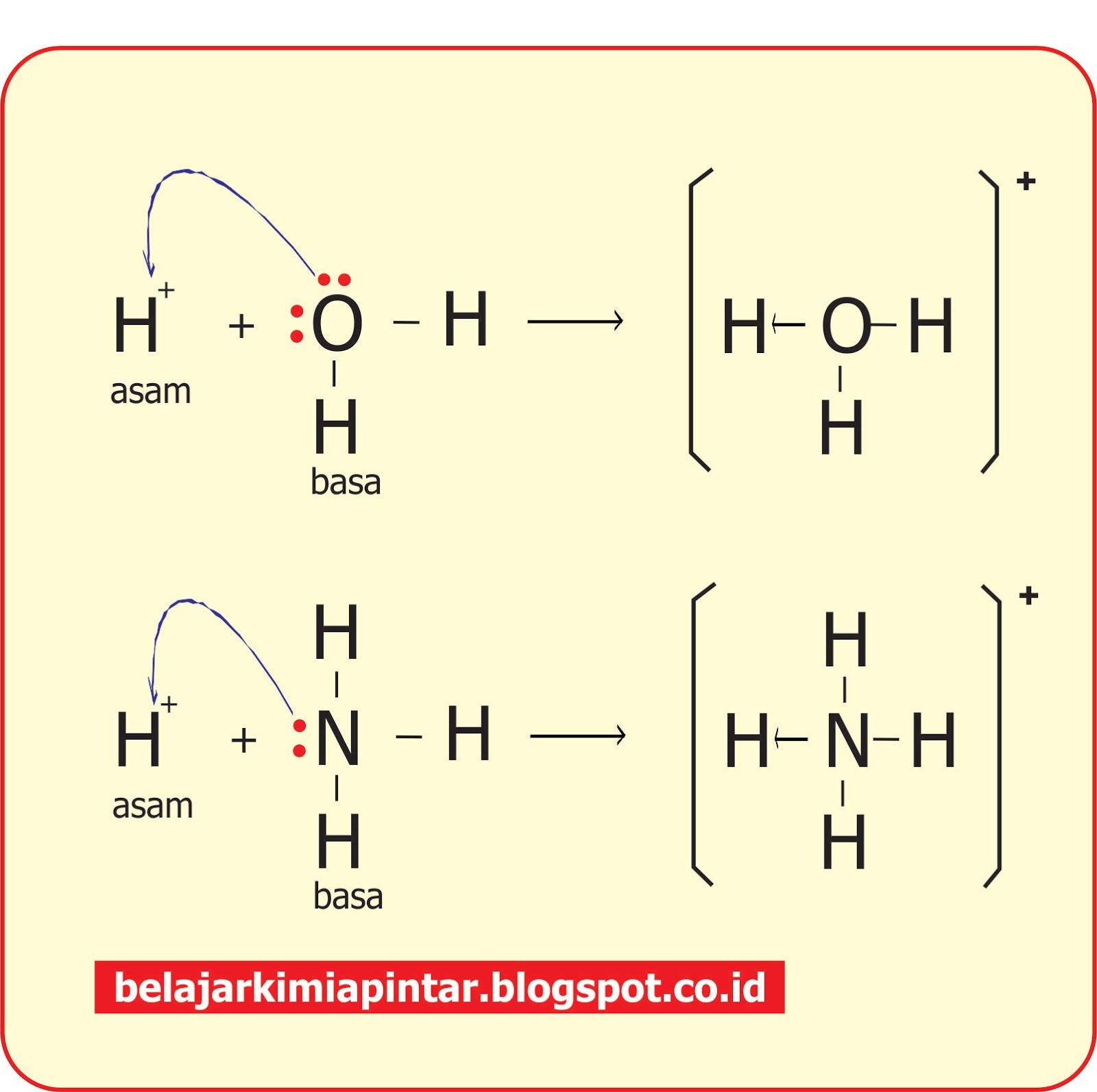
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
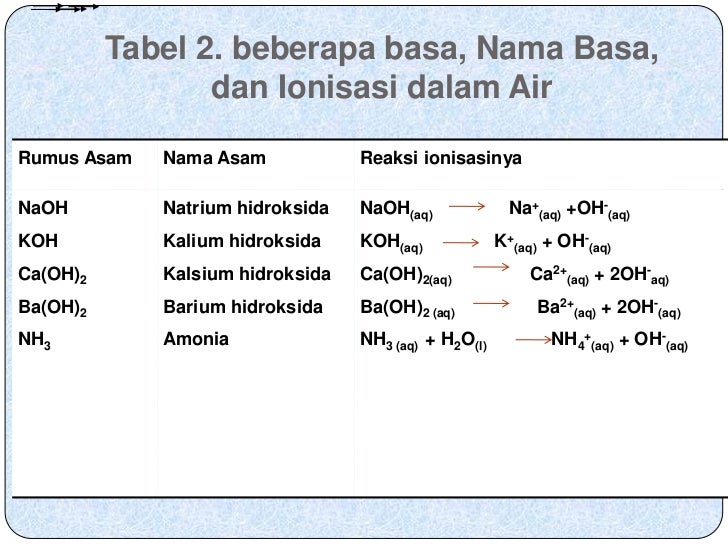
Dijelaskan dalam Jurnal UNY, teori Arrhenius menyimpulkan: 1. Asam: zat/senyawa yang dapat menghasilkan H+ dalam air. HCl (aq) à H+ (aq) + Cl - (aq) 2. Basa: zat/senyawa yang dapat menghasilkan OH- dalam air. NaOH (aq) à Na+ (aq) + OH - (aq) • Reaksi netralisasi adalah reaksi antara asam dengan basa yang menghasilkan garam:
5 Tahapan Reaksi Kimia kabarmedia.github.io
Pada reaksi mana air dapat bertindak sebagai basa? A. H2O + H2SO4 H3O+ + HSO4-B. H2O + CO32 - OH- + HCO3-C. H2O + CO2 H2CO3 D. H2O + NH3 NH4+ + OH-. Prinsip kerja larutan penyangga basa sebagai berikut : 1) Pada penambahan asam Bila yang ditambahkan suatu asam, maka Ion H+ dari asam akan mengikat

Mengenali Reaksi Kimia
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Asam = donor H+. Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20.

Contoh Soal Reaksi Asam Basa Konjugasi Kumpulan Contoh Soal My XXX Hot Girl
Beberapa senyawa dapat bertindak sebagai asam lemah atau basa lemah, tergantung pada situasinya. Contohnya adalah hidrogen fosfat, HPO 4 2-, yang dapat bertindak sebagai asam atau basa dalam air. Ketika reaksi yang berbeda dimungkinkan, konstanta kesetimbangan dan pH digunakan untuk menentukan ke arah mana reaksi akan berlangsung.

Sifat Asam Dan Basa Dari Air
Teori ini juga berguna dalam menjelaskan pengaruh larutan asam dan basa pada reaksi kimia dan pengembangan teknologi kimia organik.. di mana logam sentral dapat bertindak sebagai asam dan molekul pendonor elektron dapat bertindak sebagai basa. Dalam senyawa kompleks, logam sentral umumnya memiliki kecenderungan untuk menerima pasangan.

Teori Asam Basa
Air dapat menjadi pelarut dari berbagai macam zat termasuk untuk menjadi pelarut pada asam dan basa.. Mengutip dari modul Interaksi Alam Basa dan Kehidupan (2018) Kemdikbud, sebagai pelarut yang mampu melarutkan banyak macam zat, air memiliki sifat elektrolit yang lemah. Molekul air mudah terionisasi dari H2O menjadi: ion H+ dan OH- Dengan.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Hallo ka Tiara T. Kaka bantu jawab yaa.. Izin mengoreksi ya ka, mungkin maksudnya "HSO4-" bukan "HSO4+" Jawaban: reaksi A : H2O + H2SO4 --> H3O+ + HSO4- Agar lebih paham simak pembahasan berikut ya^^ Teori asam basa menurut Bronsted-Lowry yaitu sebagai berikut: - Asam adalah zat yang memberikan atau donor proton (H+) - Basa adalah zat yang dapat menerima atau akseptor proton (H+) - Asam.