
CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA ADA YANG TIDAK SAMA YouTube
Orde pertama. Orde pertama adalah laju reaksi bergantung pada satu reaktan dan jumlah eksponennya satu. Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair ArN 2+ + X − → ArX + N 2, persamaannya adalah r = k [ArN 2+ ], dan Ar merupakan kelompok aril. Contoh reaksi orde pertama lainnya adalah proses peluruhan.

Menghitung Orde Reaksi Total dari Suatu Reaksi YouTube
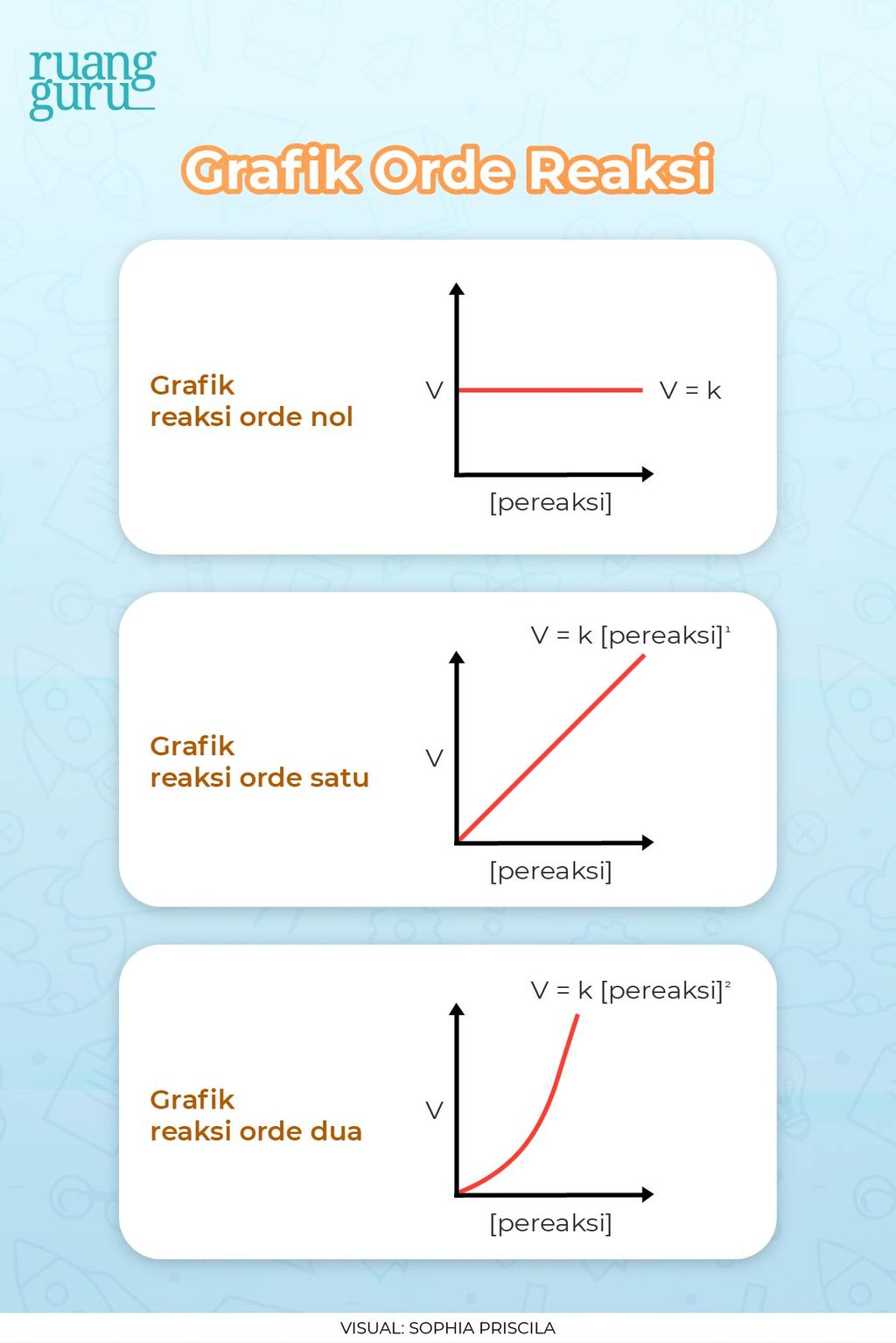
A. Pengertian Orde Reaksi Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi pada laju reaksi. B. Rumus Orde Reaksi Beberapa orde reaksi yang umum terdapat dalam persamaan reaksi kimia beserta rumusnya adalah sebagai berikut. 1. Reaksi Orde Nol (0) Suatu reaksi kimia dikatakan mempunyai orde reaksi nol, jika besarnya laju reaksi tersebut tidak dipengaruhi oleh konsentrasi

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
Dapat dikatakan reaksi orde 2 adalah ketika laju perubahan pada konsentrasi pereaksi dua kali yang pada akhirnya akan menyebabkan terjadinya laju reaksi lebih cepat empat kali dan seterusnya. Dimana ketika konsentrasi reaktan reaksi orde 1 dikalikan dengan faktor n, maka nilai yang dimiliki oleh laju reaksi adalah n2 yang lebih besar..

Cara Menentukan Orde Reaksi Perlu Melalui Percobaan
Maka diperoleh bahwa orde reaksi Natrium monoksida (NO) adalah 2 dan orde reaksi bromin (Br2) adalah 1. Tentukan tetapan persamaan laju reaksi Nitrosil bromida (NOBr2) menggunakan data percobaan yang pertama: Jadi, kecepatan laju reaksi pembentukan Bromin adalah sebesar 6 molar per detik. Hal ini berarti pada reaksi antara Natrium monoksida dan.

Orde reaksi NO dan Br2 berdasarkan data reaksi berikut. 2...
Reaksi orde pertama (di mana orde = 1) memiliki laju yang sebanding dengan konsentrasi salah satu reaktan. Laju reaksi orde satu sebanding dengan konsentrasi salah satu reaktan. Contoh umum dari reaksi orde pertama adalah peluruhan radioaktif, proses spontan di mana inti atom yang tidak stabil pecah menjadi fragmen yang lebih kecil dan lebih.

Grafik Yang Menyatakan Reaksi Orde Satu Adalah…
Orde reaksi ini tidak ditentukan dari koefisien reaksi, tapi dari data eksperimen. Nilai suatu orde reaksi dapat berupa bilangan positif, pecahan, nol,atau negatif.Secara matematis, nilai orde reaksi total adalah penjumlahan orde reaksi seluruh zat reaktan. Contoh: Macam-macam orde reaksi total beserta grafik dijelaskan pada gambar di bawah ini: a.

Persamaan Laju Reaksi dan Orde Reaksi Your Chemistry A+
Pemilu pada masa Orde Baru, dilaksanakan sebanyak enam kali, yang dimulai pada 1971 dan pemilu terakhir berlangsung pada 1997. Dari enam kali pemungutan suara tersebut, hanya Pemilu 1971 yang diikuti oleh 10 partai politik (parpol). Sepuluh parpol yang dimaksud adalah Golkar, PNI, NU, PSII, Parmusi, IPKI, Perti, Parkindo, Murba, dan Partai Katolik.

Persamaan laju reaksi orde reaksi Kimia SMA YouTube
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Orde reaksi dan tetapan laju reaksi dapat ditentukan melalui eksperimen. Perhatikan contoh soal berikut! Gas nitrogen monoksida dan gas brom bereaksi pada 00C menurut persamaan reaksi 2NO(g) + Br2(g) → 2NOBr(g) Laju reaksinya diikuti dengan mengukur pertambahan.
Video belajar Soal Menentukan Orde dan Persamaan Laju Reaksi dengan 1 Reaktan Kimia untuk Kelas
Orde reaksi ini beda dengan orde lama ataupun orde baru yang ada di mapel sejarah, ya. Orde reaksi itu merupakan pangkat molaritas dalam persamaan laju reaksi. Mudahnya, orde reaksi itu adalah tingkat reaksi. Orde Reaksi. Orde reaksi menampilkan hubungan antara perubahan konsentrasi dengan perubahan laju reaksi. Nah, hubungan antara keduanya.

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Terdapat tiga macam orde reaksi yang umumnya dijumpai dalam persamaan laju reaksi. Ketiganya ialah Reaksi Orde Nol, Reaksi Orde Satu, dan Reaksi Orde Dua. Reaksi Orde Nol terjadi jika laju reaksinya tidak dipengaruhi konsentrasi pereaksi. Sedangkan, Reaksi Orde Satu terjadi ketika besar laju reaksi berbanding lurus dengan besarnya konsentrasi.

PPT LAJU DAN ORDE REAKSI PowerPoint Presentation, free download ID4536240
Latihan Soal Hukum Laju Reaksi (Sukar) Apabila dalam suatu reaksi jumlah reaktan digandakan dan ternyata laju reaksi menjadi delapan kali lipat, maka reaksi itu adalah reaksi orde ke. . Belajar Modul, Rumus, & Soal Hukum Laju Reaksi dan kuis interaktif.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
Secara umum konsentrasi pereaksi akan mempengaruhi laju, pengaruh konsentrasi terhadap laju suatu reaksi untuk adalah khas untuk setiap reaksi. Pada reaksi orde-0 (nol) perubahan konsentrasi pereaksi tidak berpengaruh terhadap laju reaksinya. Reaksi orde-1 (satu) setiap kenaikan konsentrasi dua kali akan mempercepat laju reaksi menjadi dua kali.

Cara Menentukan Orde Reaksi & Grafik yang Sesuai (UN Kimia 2018 No. 15) YouTube
Pada persamaan laju reaksi, orde reaksi adalah jumlah dari orde reaksi terhadap masing-masing zat pereaksinya. Pada reaksi sederhana (biasanya berlaku untuk reaksi homogen), orde reaksi dapat ditentukan berdasarkan koefisien reaksinya. Misalnya reaksi A(g) → B(g) memiliki orde reaksi 1 dan A(g) + 2B(g) → C(g) memiliki orde reaksi 1 + 2 = 3.

Contoh Soal Laju Reaksi YouTube
Orde pertama. Jika laju reaksi bergantung pada satu reaktan dan jumlah eksponennya satu, maka reaksi itu adalah reaksi orde pertama. Contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair ArN 2 + + X − → ArX + N 2, persamaannya adalah r = k[ArN 2 +], dan Ar merupakan kelompok aril. Contoh reaksi orde pertama lainnya adalah proses peluruhan radioaktif.

WANIBESAK Makna Orde Reaksi dalam Laju Reaksi
Orde reaksi adalah suatu eksponen atau pangkat dari konsentrasi reaktan terhadap laju reaksi keseluruhan. Pada umumnya kita akan mempelajari reaksi berorde nol, satu dan dua, meski juga terdapat reaksi dengan orde pecahan maupun negatif.

Orde reaksi
Atau untuk reaksi : A + 2 B produk dengan hukum laju v = k [A] [B]2 maka orde reaksi totalnya adalah 3 yang berasal dari pangkat [A] =1 + pangkat [B] = 2. Sedangkan orde reaksi terhadap konsentrasi A adalah 1 dan orde reaksi terhadap komponen B adalah 2. Pada umumnya orde reaksi terhadap suatu komponen tidak selalu sama dengan koefisien dalam.