
Soal Kimia Reaksi Oksidasi Reduksi Kelas X Sma
Jawaban: Oksidasi 1 mol Cr3+ menjadi CrO4^2- melepaskan elektron sebanyak 3 elektron Berdasarkan konsep perubahan bilangan oksidasi, reaksi reduksi adalah reaksi yang mengalami penurunan bilangan oksidasi. Sedangkan reaksi oksidasi adalah reaksi yang mengalami kenaikan bilangan oksidasi. Reaksi oksidasi yang belum setara adalah: Cr3+ → CrO4^2.

Oksidasi 1 Mol Cr3+ Menjadi Cro42 Melepaskan Elektron Sebanyak salah satu titik sampel
Oksidasi 1 mol Cr^3+ menjadi CrO4^2- melepaskan elektron seb. kimia kimia fisik dan analisis reaksi redoks dan sel elektrokimia penyetaraan persamaan reaksi redoks Copy Link
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi My XXX Hot Girl
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol. Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol C. 3 mol 4. Diberikan persamaan reaksi (belum setara) :
.png)
Reaksi Redoks Pengertian, Ciri, Konsep, dan Menentukan BIlangan Oksidasi
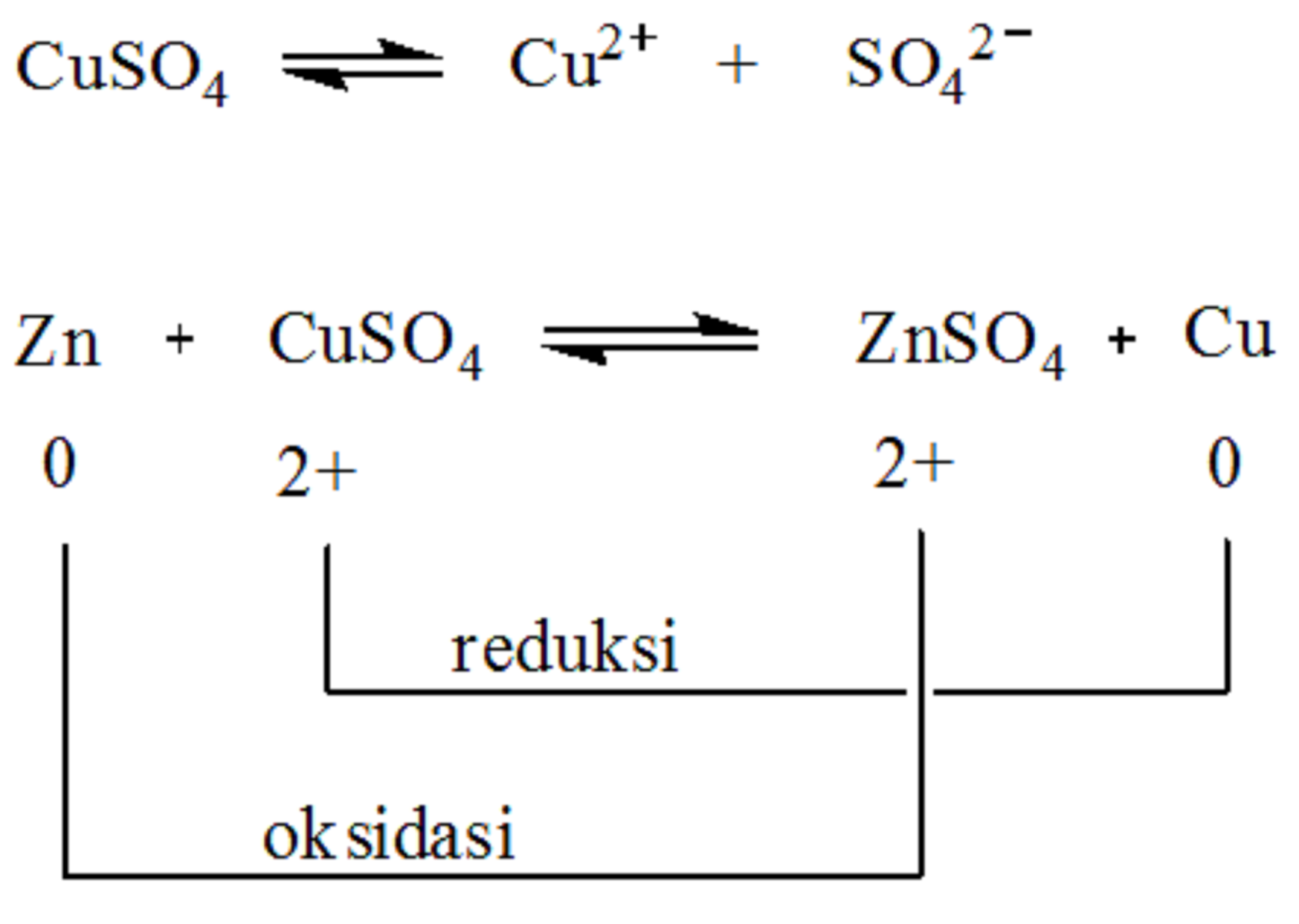
Timbal ( S n 2 − Sn^{2-} ) mengalami oksidasi karena kehilangan dua elektron menjadi timbal ( S n 4 + Sn^{4+} ) Oleh karena itu, ini adalah reaksi redoks. Bilangan Oksidasi : Bilangan Oksidasi besi ( F e Fe ) berubah dari +3 menjadi O. Bilangan oksidasi timbal ( S n Sn ) berubah dari -2 menjadi +4. Baca juga: Hukum.
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol. Oks : 3e- Artinya : 1 mol Cr3+ akan melepas 3 mol elektron. @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 14. Mn2+ diperlukan larutan KMnO4 0,1 M sebanyak.. A. 200 ml D. 20 ml B. 100 ml E. 10 ml

Reaksi Reduksi Oksidasi dalam Kimia Organik (Kimia SBMPTN, UN, SMA) YouTube
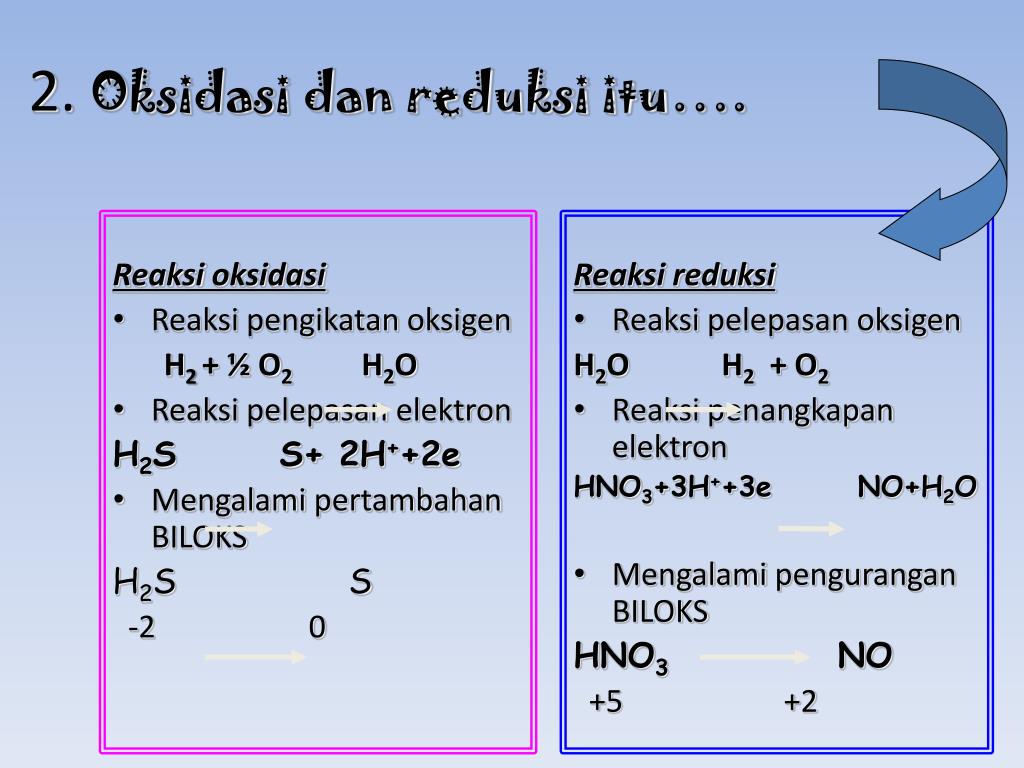
Unsur-unsur bahkan dalam bentuk molekul ini kerap kali mempunyai bilangan oksidasi nol. Pada reaksi diatas hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sementara itu fluorin tereduksi dari bilangan oksidasi 0 menjadi -1. Saat reaksi oksidasi dan reduksi digabungkan elektron yang terlibat akan saling mengurangi:

Metode PBO, Penyetaraan 38 CrI3 + H2O2 + OH → CrO42 + IO4 + H2O (Basa) YouTube
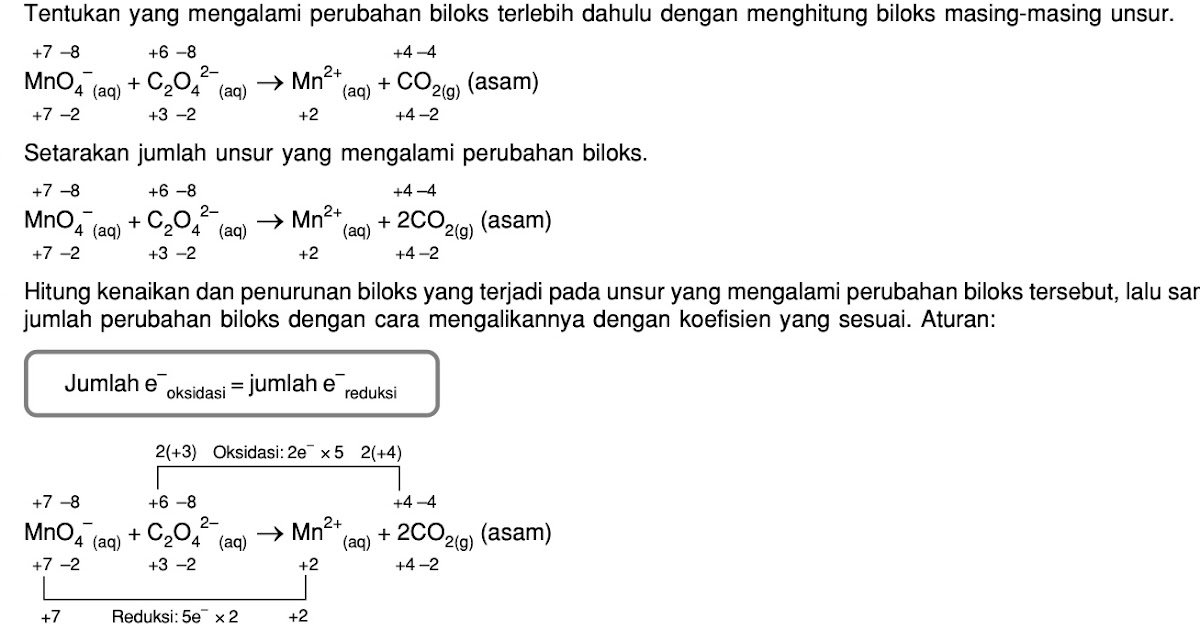
A. 1 D. 4 B. 2 E. 5 C. 3 @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 20 Modul Kimia Kelas XII KD 3.3 Kunci Jawaban dan Pembahasan Soal Latihan No Kunci Pembahasan 1 E (1)MnO4- → MnO2 (Terjadi pelepasan oksigen → reduksi) (2) Zn → ZnO2- (Terjadi pengikatan oksigen → oksidasi) +4 -4 +6 -8 (3) 2CO2 → C2O42.

Metode PBO, Penyetaraan 9 CrO42 + Fe(OH)2 → Cr2O3 + Fe(OH)3 (suasana basa) YouTube
Oksidasi 1 mol Cr³ menjadi CRO4- melepaskan selektif sebanyak. SD. Oksidasi 1 mol Cr³ menjadi CRO4- melepaskan selektif sebanyak. 9. 0.. Tulislah nama yang benar untuk senyawa di bawah ini menggunakan Sistem Yunani dan Bilangan Oksidasi! (j)PCI5. 17. 0.0. Jawaban terverifikasi.

Contoh Soal Beserta Jawaban Oksidasi Elektron
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol. Oks : 3e- Artinya : 1 mol Cr3+ akan melepas 3 mol elektron. @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 14. Untuk mengoksidasi 2 mol ion C2O42- diperlukan ion MnO4- sebanyak.. A. 0,3 mol D. 0,8 mol B. 0,5.

Contoh Soal Bilangan Oksidasi Dan Jawabannya Contoh Soal Terbaru
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol . B. 2 mol . C. 3. Jumlah H+ dan elektron terlibat yang tepat untuk setengah reaksi oksidasi Cr3+ menjadi CrO42- pada suasana asam adalah.. A. 4H+ dan 3e-. Untuk mengoksidasi 2 mol ion C2O42- diperlukan ion MnO4- sebanyak.. A. 0,3 mol . B. 0,5 mol . C.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Metode IE/SR, Penyetaraan 12 Cr(OH)3 + H2O2 → CrO42 + H2O (suasana basa) YouTube
Oksidasi 1 mol Cr2+ menjadi CrO4²- melepaskan elektron sebanyak.. - 12228527. baniot baniot 15.09.2017 Kimia Sekolah Menengah Atas terjawab • terverifikasi oleh ahli Oksidasi 1 mol Cr2+ menjadi CrO4²- melepaskan elektron sebanyak.. 1 Lihat jawaban itu kak yang Cr2+ jadi CrO4²- itu melepas brp elektron

Menghitung Bilangan Oksidasi Unsur
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Oksidasi 1 mol Cr^3+ men.
Setarakan Reaksi Berikut Dengan Metode Bilangan Oksidasi Cr O My XXX Hot Girl
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol C. 3 mol 4. Diberikan persamaan reaksi (belum setara) : IO3- (aq) + I- (aq) + H+ (aq) → I2 (aq) + H2O (l) Perbandingan mol I- terhadap I2 pada reaksi setara adalah..
Perbedaan Reaksi Oksidasi Dan Reduksi Hisham Id My XXX Hot Girl
Oksidasi 1 mol Cr3+ menjadi CrO42− melepaskan elektron sebanyak.. 1 mol. 2 mol. 3 mol. 4 mol. 5 mol. Iklan. SL. S. Lubis.
PERCOBAAN VIII REAKSI REDOKS Kimia Dasar II Najih Web Id 30240 Hot Sex Picture
A. 0,3 mol D. 2 mol B. 0,5 mol E. 3 mol C. 1 mol 3. Oksidasi 1 mol Cr2- menjadi CrO4 2- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol C. 3 mol 4. Pada reaksi KMnO4 + H2 SO4 + H2 C2 O4 K2 SO4 + MnSO4 + CO2 + H2 O. Dari 0,1 mol KMnO4 akan menghasilkan gas CO2 pada STP sebanyak.