
MULA MULA Video Song "RAJAHAMSA" Kannada Movie Gowrishikar, Ranjani YouTube
Pereaksi Pembatas adalah pereaksi yang habis lebih dulu dalam sebuah reaksi kimia. Sesuai namanya, pereaksi pembatas akan membatasi jumlah produk yang dapat dihasilkan. Oleh karena itu, kita perlu mengetahui Cara Menentukan Pereaksi Pembatas dalam reaksi kimia. Sebelum membahas lebih lanjut, mari perhatikan daftar isi berikut.

Kasih MulaMula Petrus Kwik YouTube
Langkah 2. Menyetarakan persamaan reaksi. Fe (s) + S (s) → FeS (s) Langkah 3. Mencari perbandingan mol dan menentukan zat yang habis bereaksi. Zat yang habis bereaksi ini berperan sebagai pereaksi pembatas dan zat yang tidak habis bereaksi berperan sebagai pereaksi sisa. Perbandingan mol Fe = jumlah mol Fe/koefisien Fe = 0,5/1 = 0,5 mol.

KEHILANGAN KASIH MULA MULA YouTube
Persamaan reaksi mrs (mula-mula, bereaksi, sisa) dapat dituliskan sebagai berikut. Jadi, pereaksi pembatas dan pereaksi yang berlebih berturut-turut adalah HCl dan Al ( OH ) 3 . Sebelum penentuan pereaksi pembatas dan pereaksi berlebih terlebih dahulu kita hitung mol masing-masing pereaksi.

Secara umum, faktor van't Hoff (i) untuk larutan elektril...
masih bingung kapan pakai mula-mula reaksi sisa? kapan ga perlu pakai? ini kakak kasih CARA MASTER namanya cara SUKA. disimak yaIG: Kakandrian

Mengenal Reaksi Stoikiometri Pereaksi Pembatas Dan Contoh Soalnya Riset
2. 2BOH + H 2 A → B 2 A + 2H 2 O. 3. B (OH) 2 + 2HA → BA 2 + 2H 2 O. 4. B (OH) 2 + H 2 A → BA + 2H 2 O. Skema reaksi basa kuat dengan asam kuat serta sifat campurannya. Rutinitas penyelesaian soal yang terkait pereaksi pembatas bisanya membuat tabel reaksi, menghitung jumlah zat mula-mula-bereaksi-sisa, berulang terus seperti itu. Dengan.

Kehilangan Kasih MulaMula
Tentukan terlebih dahulu mol mula-mula besi dan belerang, kemudian dibagi dengan koefisien reaksi, seperti dibawah ini. → mol =. Mol Fes yang dihasilkan/bereaksi = 0,1 mol. Atas dalam massa FeS = mol x Mr FeS = 0,1 x (56 + 32) = 8,8 g. Soal ini jawabannya B.. Jadi pereaksi sisa Na 2 CO 3 sebanyak 150 mol. Soal ini jawabannya E.

15 Kesaksian Jemaat GBI FOL9 April 2023Kuasa KebangkitanNya Mengobarkan Api Cinta MulaMula
Hal ini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih dahulu. Hal inilah yang disebut pereaksi pembatas.. sedang perekasi-pereaksi yang lain akan meninggalkan sisa. Menentukan Pereaksi Pembatas. Contoh: Satu mol larutan. mula-mula: 1 mol 1 mol 0 0 bereaksi: (2x0,5) = 1 mol (1x0,5) = 0,5 mol

INSPIRASI KHOTBAH 4 Point 1) Gejala Hati Kehilangan Cinta MulaMula! YouTube
Latihan Soal Hukum Proust (Sedang) Untuk membentuk FeS, 28 gram belerang bereaksi dengan besi. Berapakah massa mula-mula Besi yang bereaksi membentuk Besi (II) sulfida (FeS) jika pada akhir reaksi terdapat 3 gram besi? (Ar Fe = 56; S = 32).

Rajahamsa Mula Mula Lyrical Video Song Gowrishikar, Ranjani Raghavan Haricharan YouTube
Sementara itu, reaktan B hanya bereaksi 3 mol saja sehingga sisa 2 mol. Nah, pereaksi yang habis disebut pereaksi pembatas (limiting reagent). - Jika zat yang habis adalah zat A, maka 1 mol zat A bereaksi dan 0,5 mol zat B bereaksi. Sehingga mula-mula zat B memiliki 1 mol, dipakai bereaksi 0,5 mol, tersisa 0,5 mol. Maka,.

MULA MULA Byron Parfums
Dalam suatu reaksi kimia, tidak selalu massa zat-zat yang bereaksi (zat reaktan) habis bereaksi seluruhnya membentuk hasil reaksi. Kadang-kadang, salah satu dari zat reaktan memiliki massa yang bersisa karena tidak habis bereaksi. Hal ini karena untuk terjadinya reaksi secara sempurna, perbandingan massa zat-zat reaktan tersebut harus tepat.

Kesetimbangan part 2 kimia SMA YouTube
Hasil mol koefisien HCl < Fe, sehingga HCl sebagai pereaksi pembatas. Selanjutnya jumlah mol dari limiting reagent inilah yang menentukan jumlah mol reaksi/hasil reaksi. Misal dari contoh soal tersebut ditanyakan massa FeCl2 yang terbentuk, sehingga. nFeCl2 = 1 2 × mol HCl = 1 2 × 0, 1 mol = 0, 05 mol mFeCl2 = 0, 05 × 127 gram = 6, 35 gram.

Kimia mol pada pereaksi pembatas contoh soal YouTube
Bersifat kualitatif yaitu menunjukkan apa yang bereaksi dan apa yang. Mula-mula : 10 12 16,38 Bereaksi : 10 10 15 10 30 Sisa : 0 2 1,38 10 30 Propilen habis bereaksi, sedangkan amonia dan udara mencukupi untuk bereaksi dengan propilen secara stoikiometris. Sehingga limiting.

"Rasa Macam MulaMula Beli Kereta" YouTube
Pada baris "mula-mula" atau awal reaksi, konsentrasi yang ada hanyalah reaktan, yaitu N 2 O 5, sementara konsentrasi hasil masih nol (belum ada hasil yang terbentuk): Mula-mula: 0,25 M - - Reaksi. Jadi, banyaknya NO 2 yang bereaksi adalah 0,1 M:

mula mula Mula Mula adds to buzz around ‘Rajahamsa’
Untuk memahami perhitungan pH campuran asam dan basa, ingat kembali konsep MBS (Mula-mula, Bereaksi, dan Sisa), yang telah dipelajari di stoikiometri! A. Perhitungan pH asam kuat + basa kuat. Perhitungn pH asam kuat + basa kuat akan menghasilkan garam yang bersifat kuat dan sejumlah air. Besarnya pH pada perhitungan ini, didasarkan pada:
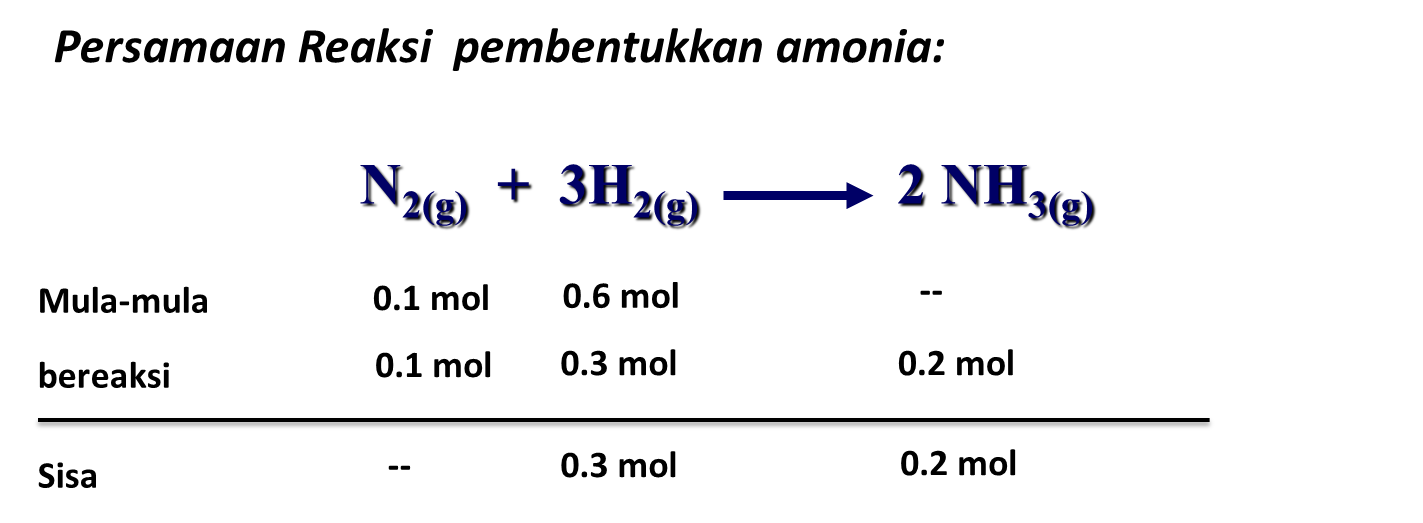
Cara Menentukan Pereaksi Pembatas dan Pereaksi Sisa Materi Kimia
Peraksi pembatas = H 2 SO 4 Pereaksi sisa = NaOH Jenis reaksi = Non Stoikiometri. 4.4 Pembahasan. Stoikiometri pada praktikum kali ini adalah suatu perhitungan kimia yang menyangkut tentang hubungan kuantitatif antara zat yang terlibat dalam reaksi yang dilakukan titik dalam reaksi stoikiometri sendiri reaksi yang berada di dalam reaksi kimia tersebut harus habis bereaksi dalam reaksi kimia.

KAPAN REAKSI PAKA MULAMULA REAKSI SISA? (Reaksi Pembatas Vs Pereaksi Biasa) YouTube
Untuk lebih memahami materi pereaksi pembatas, perhatikan 5 contoh soal pereaksi pembatas dan pembahasannya berikut ini. Contoh Soal Pereaksi Pembatas dan Pembahasannya Pilihan Ganda Soal No. 1 Amonia dapat dibuat melalui reaksi: N2(g) + 3H2(g) → 2NH3 Jika 60 liter gas nitrogen direaksikan dengan 240 liter gas hidrogen yang diukur pada suhu dan tekanan yang