
Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Basa kuat adalah adam love Valen sederhana yang dapat mendeprotonasi asam sangat lemah di dalam reaksi asam-basa. Contoh paling umum dari basa kuat adalah hidroksida dari logam alkali dan logam alkali tanah seperti NaOH dan Ca(OH) 2. Berikut ini adalah daftar basa kuat: Kalium hidroksida (KOH) Barium hidroksida (Ba(OH) 2) Cesium hidroksida (CsOH)

Asambasa menentukan konsentrasi ion OH dalam basa kuat YouTube
Selasa, 03 Januari 2017. Berapa jumlah asam kuat dan basa kuat yang pernah ada? Belum pernah ada yang menyebutkannya secara pasti jumlah masing-masing. Hanya tertulis yang sering digunakan, baik secara teori maupun eksperimen. Beberapa juga masih diperdebatkan seperti Mg (OH) 2 itu termasuk basa kuat atau basa lemah.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Umumnya sukar larut dalam air kecuali NH4OH, KOH, NaOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.-Basa kuat Pengertian basa kuat adalah senyawa basa yang akan terurai sempurna jika terlarut dalam air. Misalnya pada senyawa: NaOH, KOH, Ba(OH)2.-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada.
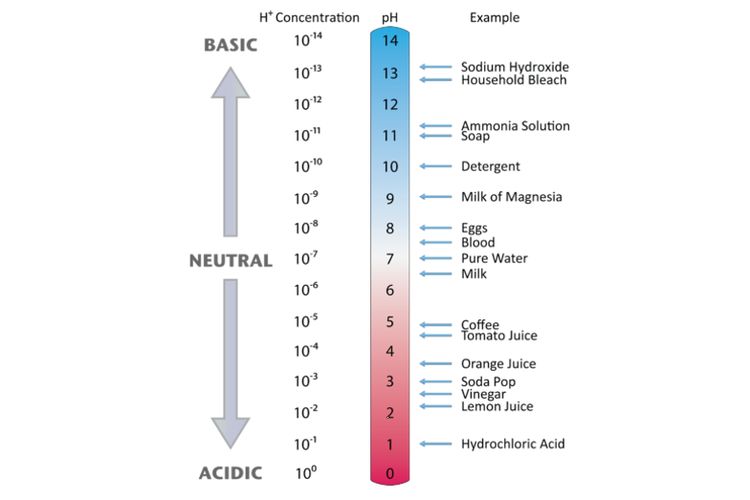
Daftar Nama AsamBasa Kuat dan AsamBasa Lemah
Diketahui larutan: HBr , Mg ( OH ) 2 , AlCl 3 , C 2 H 5 OH , H 2 SO 4 , CO ( NH 2 ) 2 dan Fe ( OH ) 3 Kelompokkan larutan-larutan tersebut sebagai berikut: a.. basa kuat dan senyawa garam yang pada umumnya merupakan elektrolit kuat. Senyawa yang termasuk elektrolit lemah diantaranya adalah senyawa asam lemah dan basa lemah, sedangkan senyawa.

Teori Asam Basa
Sementara basa adalah semua zat yang jika dilarutkan dalam air akan menghasilkan ion OH-, misalnya pada senyawa natrium hidroksida NaOH akan terurai menjadi Na+ dan OH-. Jika basa bereaksi dengan asam, maka dihasilkan senyawa 'garam'. Definisi basa menurut Arrhenius adalah senyawa yang jika dilarutkan dalam H2O atau air maka akan terurai jadi ion OH- (ion hidroksida).
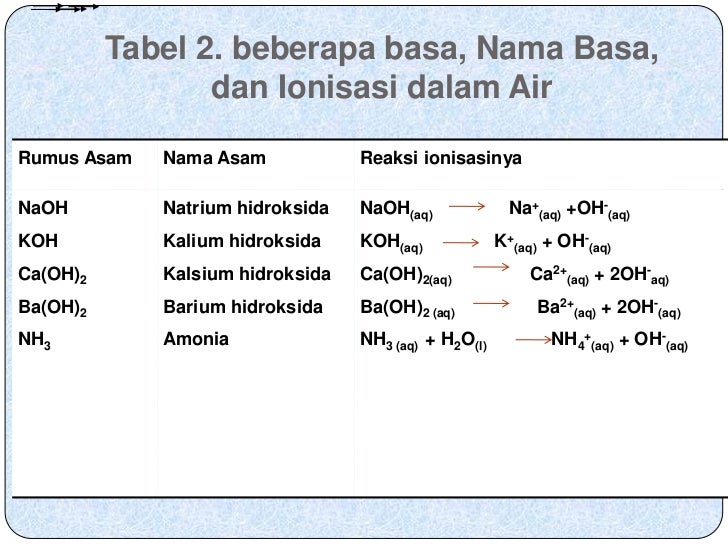
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Berikut adalah pengertian dan contoh dari basa kuat dan basa lemah! Basa kuat. Dilansir dari Chemistry LibreTexts, basa kuat adalah basa yang terionisasi secara sempurna ke dalam air. Ketika larut dalam air, setiap molekul basa kuat akan melepaskan ion hidroksida (OH-). Basa kuat memiliki pH yang tinggi, biasanya lebih besar dari 11.

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Contoh asam lemah yaitu H 3 PO 4, H 2 SO 3, HNO 2, dan CH 3 COOH. Basa lemah adalah senyawa basa yang sulit melepaskan ion OH - dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh basa lemah yaitu NaHCO 3 dan NH 4 OH. Itu tadi pembahasan kita tentang asam basa, mulai dari sifat atau cirinya, cara membedekan, hingga.

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Magnesium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Mg dan nomor atom 12.. Magnesium hidroxida adalah suatu senyawa anorganik dengan rumus kimia (dalam keadaan basah) Mg(OH) 2.Biasanya Magnesium terdapat dalam bentuk klorida, silikat, hidrat, oksida, sulfat, atau karbonat. Oksigen dalam tabel periodik memiliki simbol O dengan nomor Atom 16, Magnesium berreaksi dengan.
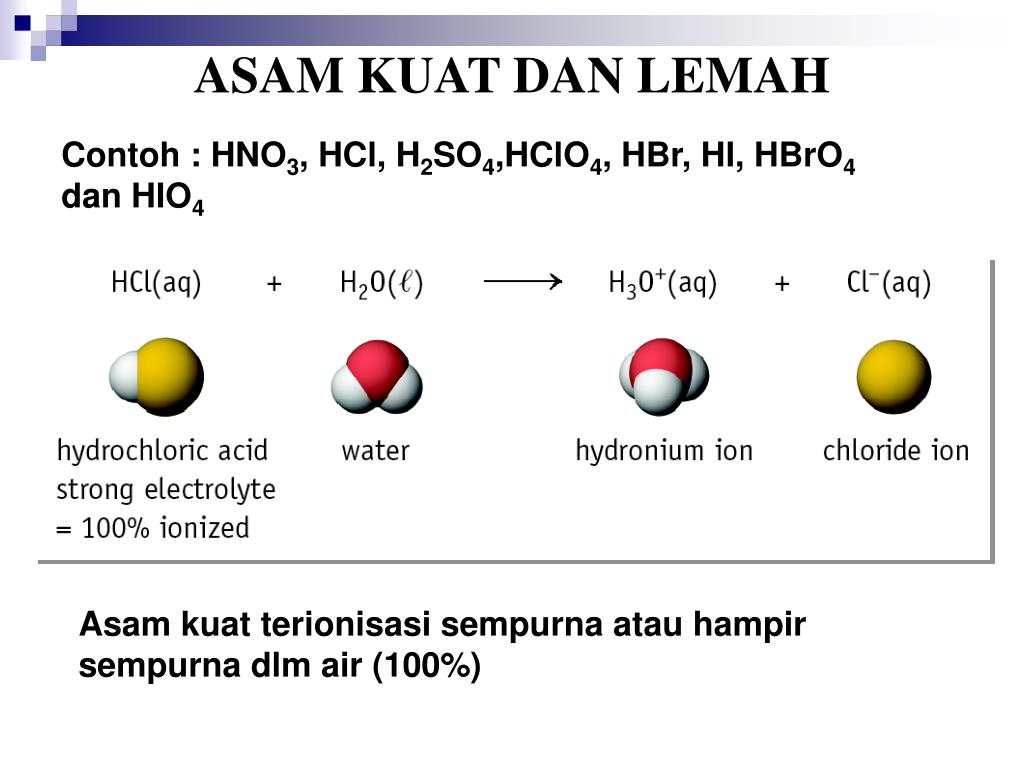
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Bahan Bahan Kimia Untuk Membuat Tinta Tak Tampak. Beberapa Contoh Basa Lemah Dan Kegunaannya Dalam kimia, basa dapat didefinisikan sebagai zat yang berdisosiasi dalam larutan berair untuk membentuk ion Hidroksida (OH−). Basa lemah adalah basa yang tidak sepenuhnya terdisosiasi menjadi ion penyusunnya ketika dilarutkan dalam larutan.

Cara Menghitung Massa Molekul Relatif (Mr) Senyawa Basa (NaOH, NH4OH, Mg(OH)2, Al(OH)3) YouTube
Natrium yang ketemu HO bersifat basa kuat, Mg(OH) 2 bersifat basa lemah, Al(OH) 3 bersifat amfoter atau peralihan, lalu dari Si ke kanan, sifatnya udah bukan basa lagi,. Jika kita melihat urutan unsur periode 3, sifat unsur paling kirilah yang merupakan pereduksi atau reduktor paling kuat. Semakin ke kanan, sifat reduktor itu akan semakin lemah.

Kelarutan Mg(OH)2 dalam NaOH YouTube
Dapatkan pemahaman yang lebih dalam tentang tabel asam basa kuat dan lemah dalam kimia! Temukan perbedaan dan karakteristik masing-masing asam dan basa yang membuat mereka menjadi kuat atau lemah. Menyajikan informasi yang bermanfaat untuk pengajar dan siswa kimia. Nikmati pembahasan lengkap dengan contoh-contoh yang menggugah rasa ingin tahu Anda di artikel ini.

Mg Oh 2 Basa Kuat Atau Lemah cara bertanya yang baik kepada guru
Basa Kuat. Pengertian basa kuat ialah jenis senyawa yang melepaskan proton (deprotonasi) pada asam sangat lemah secara sederhana dalam reaksi asam basa. Adapun contoh basa kuat yang paling umum ialah Hidroksida pada logan alkali, misalnya Ca (OH)2 maupun NaOH.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Magnesium Hidroksida atau Mg(OH) 2 tidak termasuk basa kuat karena mampu mengendap. Untuk menghitung nilai pH dan pOH dari asam kuat dapat dihitung dengan rumus berikut: dimana [H +]. Garam yang berasal dari asam kuat - basa lemah, asam lemah - basa kuat, maupun asam lemah - basa lemah dapat mengalami hidrolisis..

Daftar Asam Basa Kuat dan Lemah
Dari reaksi asam basa di atas, diketahui bahwa HCl merupakan asam kuat, sedangkan Ba(OH) 2 adalah basa kuat sehingga menghasilkan garam (BaCl 2) dan air yang netral, yaitu pH = 7. Selain itu, dari reaksi di atas juga bisa menghasilkan zat sisa berupa asam dengan pH di bawah 7 atau zat sisa berupa basa dengan pH di atas 7.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Pembahasan. Magnesium hidroksida atau termasuk basa lemah. Hal ini dikarenakan senyawa sukar larut dalam air dan hanya terlarut sebagiansaja dan menghasilkan sedikit ion . Reaksi ionisasinya adalah sebagai berikut.

Reaksi Asam Basa Rumus Kimia Contoh Soal Dan Jawaban Riset
1. Basa Kuat - Kekuatan Basa Kuat dan Basa Lemah. Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan. Secara umum, ionisasi basa kuat dirumuskan sebagai berikut. M (OH)x(aq) ⇄ Mx+(aq) + x OH-(aq) dengan: x = valensi basa. M = konsentrasi basa.