
Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
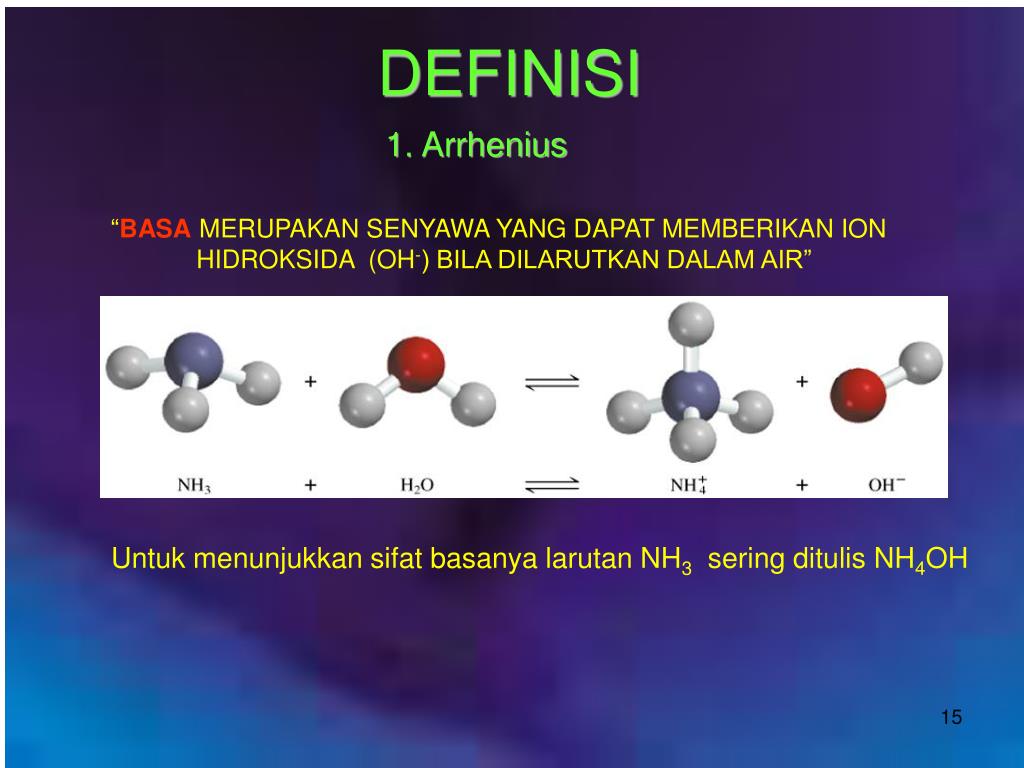
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).
PPT TEORI ASAM BASA PowerPoint Presentation, free download ID5368090
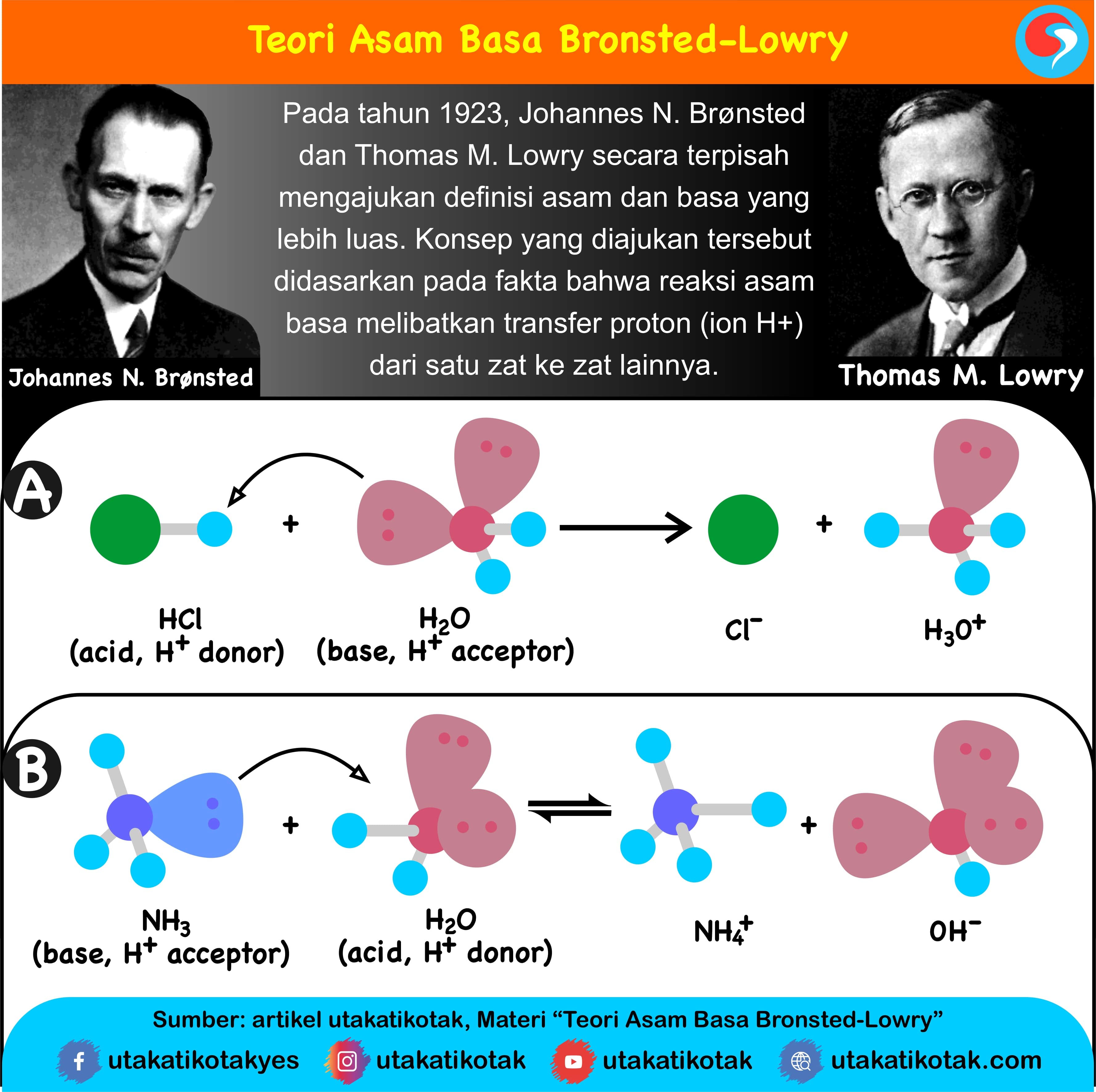
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Teori Asam Basa
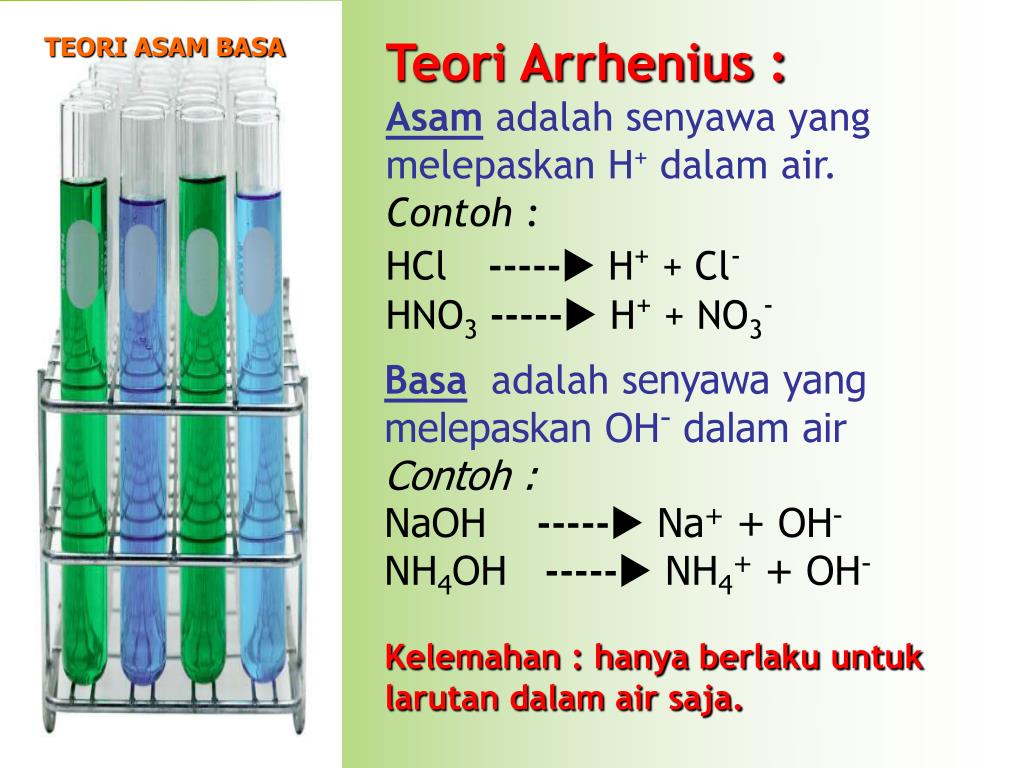
Menurut Arrhenius, asam adalah senyawa yang menghasilkan ion dalam air, sedangkan basa senyawa yang menghasilkan ion dalam air. Perkembangan teori asam basa dimulai dari seorang tokoh bernama Svante Arrhenius (1859-1927). Beliau mengemukakan teori asam-basa untuk larutan dengan pelarut air. Asam didefinisikan sebagai senyawa yang terionisasi.

TEORI ASAM BASA ARRHENIUS
Menurut Teori Asam Basa Arrhenius bahwa Asam ialah Zat yang jika didalam Air dapat melepaskan Ion Hidrogen (H+), Ion - Ion Hidrogen yang dihasilkan oleh Asam tersebut ketika dilarutkan di dlm Air terikat pada Molekul - Molekul Air (H2O) dlm bentuk Ion Hidronium adalah Ion yang Positif yg dibentuk oleh sebuah Proton (Ion Hidrogen) pada.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.
PPT TEORI ASAM BASA PowerPoint Presentation, free download ID3670924
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
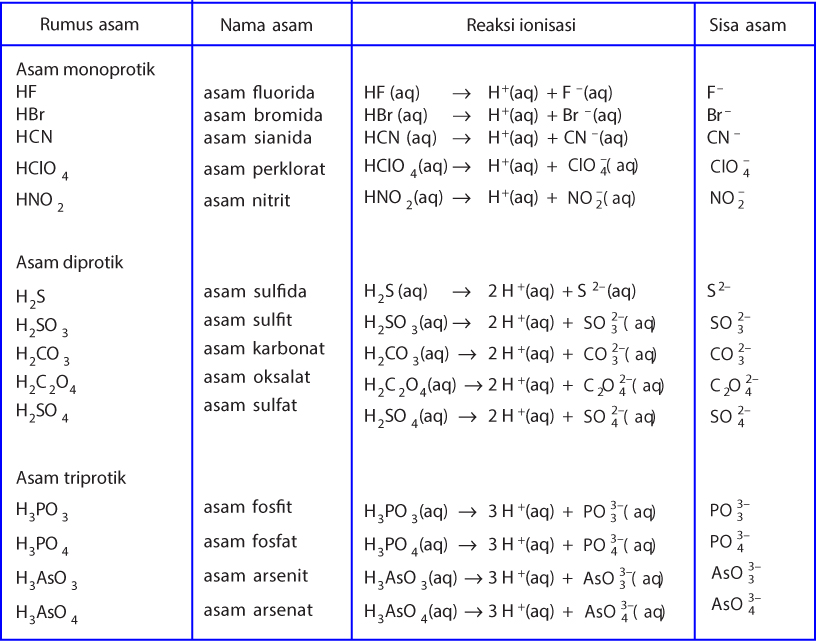
B . Teori Asam Basa 1. Teori Asam Basa Arrhenius (Svante August Arrhenius) Teori asam basa Arrhenius didasarkan pada pembentukan ion dan pada larutan berair (aqueous solution). Asam adalah spesies yang menghasilkan ion H+ atau H3O+ dalam larutan berair. contoh: HCl, H2SO4, H2CO3, H3PO4,HCN, HNO3 HCl + H2O à H+ + Cl- + H2O Basa adalah spesies yang menghasilkan ion OH- dalam larutan berair.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Setidaknya, ada teori asam basa dari tiga ilmuwan populer yang perlu diketahui. Berikut penjelasannya: Teori Arrhenius. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan basa adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion OH - dalam larutan.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
sesuai dengan teori Jacob-Monod tentang . induksi enzim.. kasar enzim selulase isolat B2S8 adalah pada .. asam atau terlalu basa da pat menyebabkan .

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

Teori Asam Basa
2. Teori Asam Basa Arrhenius. Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -.

Teori Asam Basa
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Teori Asam Basa
Teori Asam Basa Menurut Ahli. Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya. Teori Asam Basa Arrhenius. Svante Arrhenius adalah seorang ilmuwan asal Swedia yang telah berhasil mengemukakan teori asam dan basa pada tahun.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Reaksi Asam-Basa Menurut Arrhenius. Reaksi asam-basa menurut konsep Arrhenius terjadi ketika ion H+ dari asam bereaksi dengan ion OH- dari basa untuk menghasilkan air. Reaksi ini dapat direpresentasikan dalam suatu persamaan kimia sederhana: H+ (dari asam) + OH- (dari basa) → H2O (air) Ini adalah reaksi netralisasi yang menghasilkan air.

PPT TEORI ASAM BASA PowerPoint Presentation, free download ID3670924
Menurut Shikha Munjal dan Aakash Singh dalam The Arrhenius Acid and Base Theory (2020), asam kuat memiliki konsentrasi ion hydronium yang terbentuk sama dengan konsentrasi asam. Sedangkan asam lemah memiliki konsentrasi ion hidronium yang terbentuk lebih kecil daripada ion hidrogennya. Contohnya adalah asam klorida, reaksi disosiasi asam.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Teori asam basa Arrhenius menyatakan bahwa asam adalah substansi yang dapat menghasilkan ion H+ dalam larutan. Asam akan melepaskan H+ saat dilarutkan dalam air. Contoh asam adalah asam klorida (HCl), asam nitrat (HNO3), asam sulfat (H2SO4), dan lainnya. Ion H+ yang dilepaskan akan mengikat air untuk membentuk H3O+.