
Teori Asam Basa
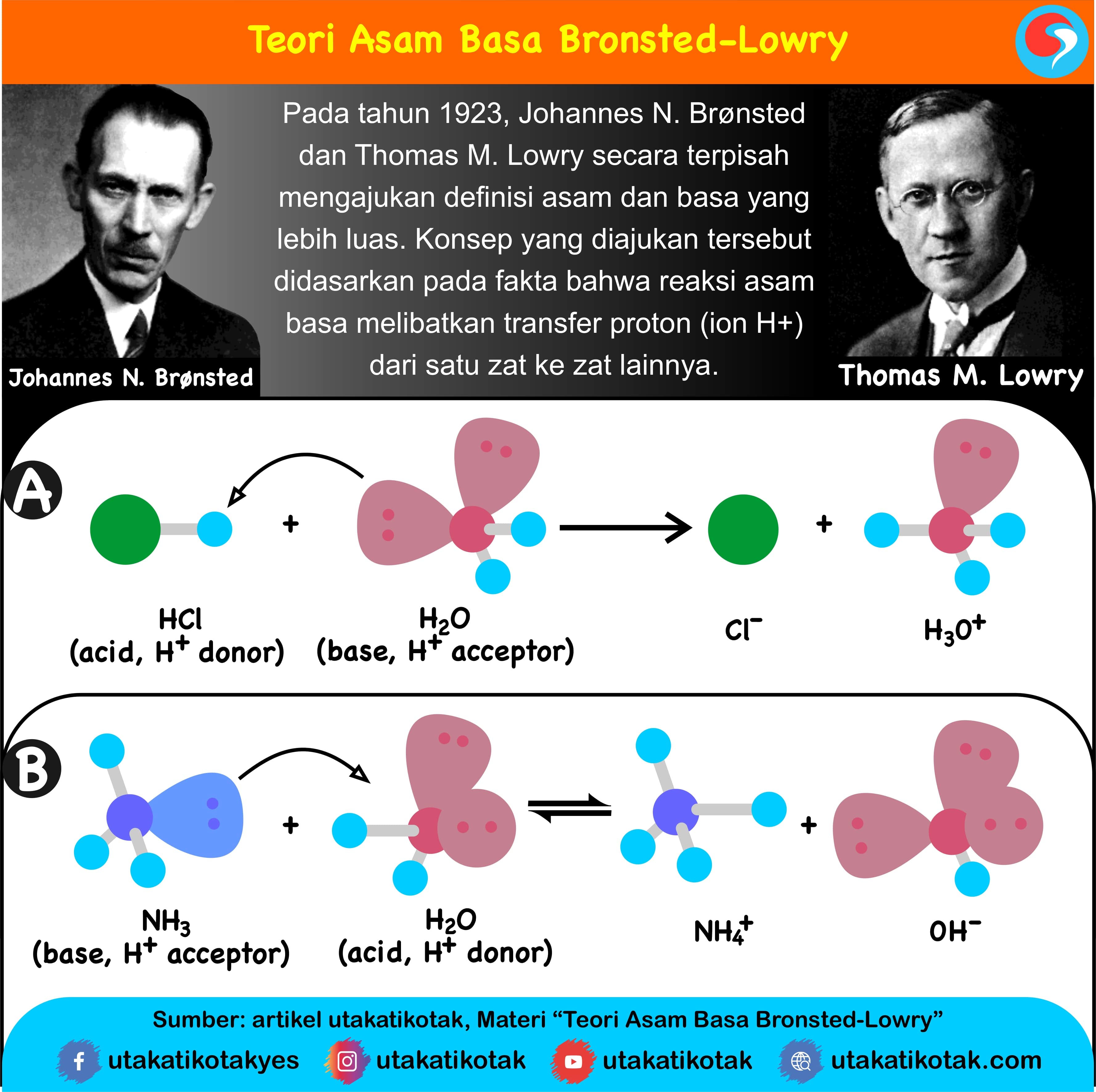
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Arrhenius, asam adalah zat yang dapat melepas ion dalam air. Sedangkan basa adalah zat yang dalam air melepas ion . Jadi, jawaban yang benar adalah B. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS! 12rb+ 4.9 (16 rating)

Asam Menurut Arrhenius Adalah Dunia Sosial
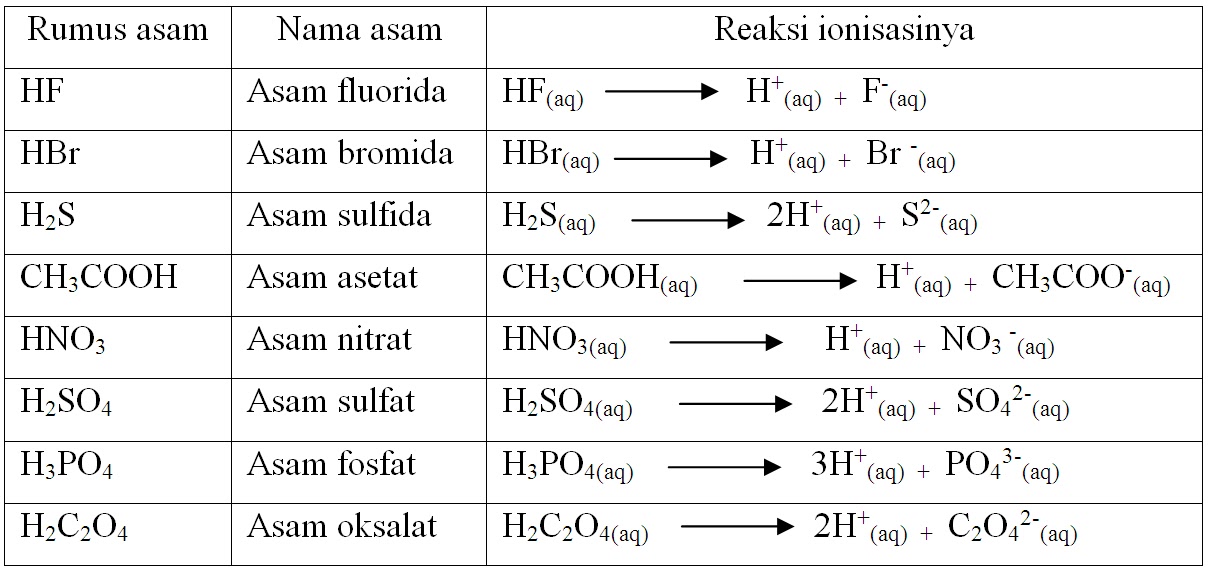
Larutan asam dan basa merupakan contoh dari larutan elektrolit. Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H +, sedangkan basa adalah zat yang dalam air melepaskan ion OH-.Jadi pembawa sifat asam adalah ion H +, sedangkan pembawa sifat basa adalah ion OH-.Asam Arrhenius dirumuskan sebagai H x Z, yang dalam air mengalami ionisasi sebagai berikut.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Teori Arrhenius. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
2. Teori Asam Basa Arrhenius. Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Teori Asam Basa Arrhenius. Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
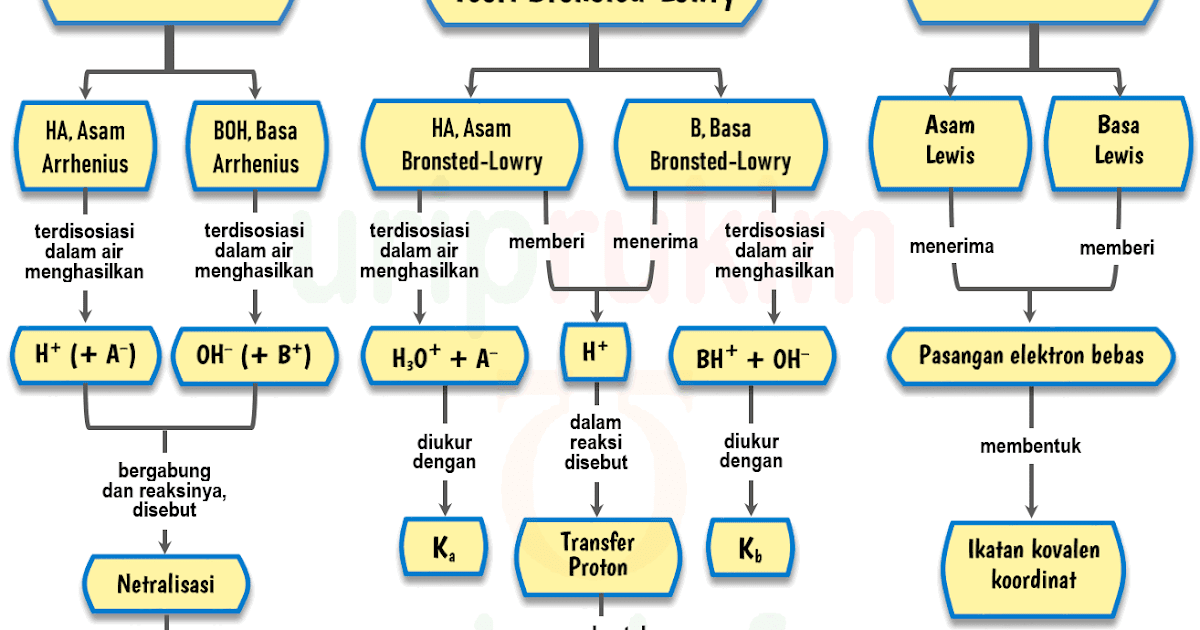
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan air. Ion hidrogen ini disebut juga sebagai kation hidronium (H3O+). Ketika asam dilarutkan dalam air, molekul asam akan bereaksi dengan molekul air, melepaskan ion hidrogen. Contoh asam yang umum adalah asam klorida (HCl) dan asam sulfat (H2SO4)..
Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Arrhenius, asam adalah suatu senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidrogen (H+), sedangkan basa adalah senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidroksida (OH-).. Asam menurut Lewis adalah zat yang dapat menerima pasangan elektron dari zat lain, sedangkan basa adalah zat yang memiliki.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

Teori Asam Basa
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Pengertian Asam Menurut Arrhenius. Menurut konsep Arrhenius, asam adalah suatu senyawa kimia yang dapat menghasilkan ion hidrogen (H+) ketika larut dalam air. Dengan kata lain, asam adalah zat yang dapat melepaskan proton (H+) dalam larutannya. Contoh yang paling umum dari asam adalah asam klorida (HCl) dan asam sulfat (H2SO4).

Definisi Asam Menurut Arrhenius Adalah
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Salah satu teori yang digunakan untuk menjelaskan sifat asam adalah teori asam dan basa Arrhenius. Teori ini dikembangkan oleh seorang ahli kimia asal Swedia bernama Svante Arrhenius pada tahun 1884. Dalam teori ini, Arrhenius mengemukakan bahwa asam adalah zat yang dapat melepaskan ion hidrogen (H+) ketika larut dalam air.