5 Tahapan Reaksi Kimia katelynjou.github.io
Reaksi Kimia dalam Konsep Kesetimbangan. Dikutip dari Modul Paket Keahlian Kimia Kesehatan SMK (2016), dalam konsep kesetimbangan, reaksi kimia berdasarkan sifat berlangsungnya, dibedakan menjadi 2, yakni reaksi satu arah (irreversible) dan reaksi dua arah (reversible). Berikut ini penjelasan dari reaksi-reaksi yang dimaksud tersebut: a.

PPT KESETIMBANGAN FASA DAN DIAGRAM FASA PowerPoint Presentation, free download ID3643142
Tidak terjadi perubahan makroskopis, tetapi terjadi perubahan mikroskopis. Perhatikan grafik kesetimbangan berikut ini: Grafik (a), Pada saat setimbang konsentrasi produk ([A]) lebih besar daripada konsentrasi reaktan ([A 2]). Grafik (b), Pada saat setimbang konsentrasi produk ([A]) lebih kecil daripada konsentrasi reaktan ([A 2]).

PPT KESETIMBANGAN KIMIA PowerPoint Presentation, free download ID3187536
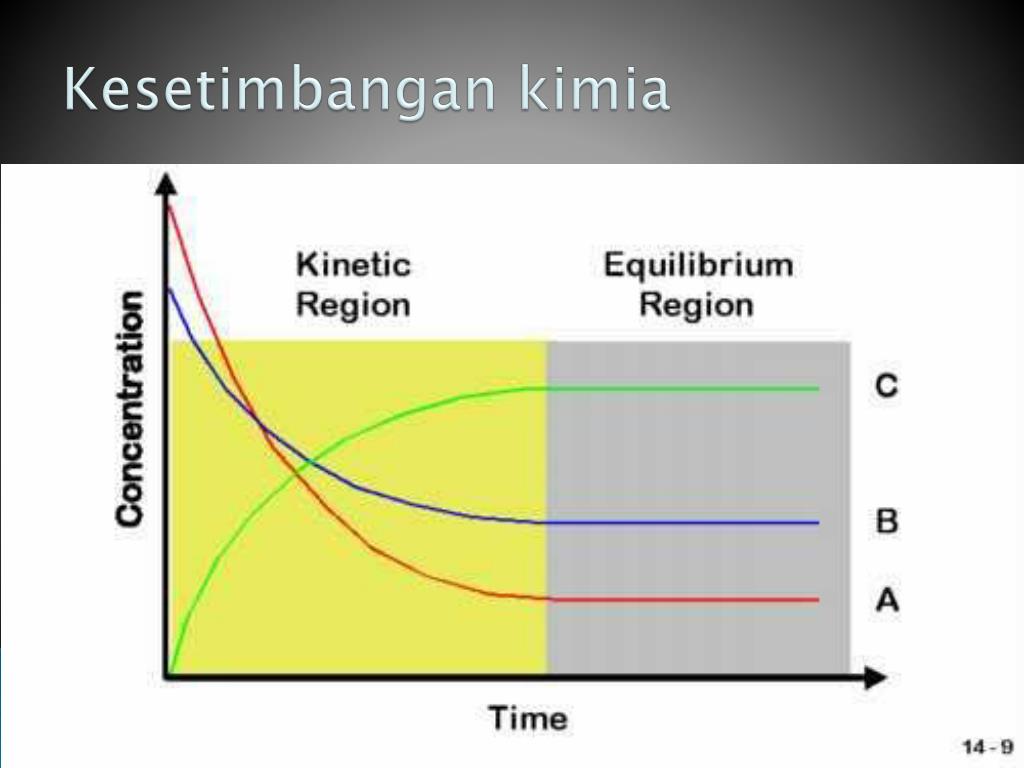
5. Pada kesetimbangan, tidak terjadi perubahan makroskopis karena partikel-partikel yang terlibat dalam reaksi bergerak dan berubah-ubah secara dinamis. Kesetimbangan adalah situasi di mana suatu sistem kimia berada dalam keseimbangan antara reaksi-reaksi yang berlangsung dalam suatu sistem.

Kesetimbangan Reaksi Homogen Ditunjukkan Oleh Reaksi peristiwa yang terjadi pada fabel
N2O4 (g) ⇄ 2NO2 (g) Tidak berwarna Cokelat Lama kelamaan reaksi seperti berhenti karena tidak terjadi lagi perubahan makroskopis, warna zat terlihat cokelat muda dan tidak berubah lagi. Sesungguhnya reaksi berlangsung terus-menerus sampai pada kondisi laju reaksi ke kanan dengan reaksi ke kiri, sehingga perubahan mikroskopis terus terjadi.

Reaksi kesetimbangan soal pergeseran ke arah mana reaksi terjadi jika suhu dinaikan kimia
1. Kesetimbangan Homogen. Sesuai dengan namanya yang mengandung kata "homogen", kesetimbangan ini merupakan jenis kesetimbangan yang terjadi pada saat produk dan juga reaktan nya berasal dari fase yang sama, yaitu seluruhnya gas (g) atau seluruhnya cairan (aq), seperti di bawah ini. aA (g) + bB (g) ⇄ cC (g) + dD (g)

Mari bertanya! Tanya MIPI
1 Penjelasan Lengkap: Mengapa Pada Kesetimbangan Tidak Terjadi Perubahan Makroskopis. 1.1 1. Kesetimbangan adalah kondisi keseimbangan fisik, kimia, atau kondisi keseimbangan biologis yang berlaku pada suatu sistem yang dinyatakan dengan keseimbangan antara faktor-faktor yang mempengaruhinya.

PPT Kesetimbangan Kimia PowerPoint Presentation, free download ID6442863
Kesetimbangan kimia hanya bisa terjadi pada tipe reaksi reversible atau reaksi bolak-balik. Untuk lebih memahami apa itu reaksi reversibel dan ireversibel berikut penjelasannya. Jumlah setiap komponen reaksi tidak berubah (tetap) Tidak ada perubahan makroskopis (perubahan yang dapat dilihat seperti perubahan warna, suhu, volume, tekanan)..

KESETIMBANGAN KIMIA 2 (PENGARUH KONSENTRASI TERHADAP REAKSI KESETIMBANGAN) YouTube
Kesetimbangan kimia memiliki sifat makroskopis yang konstan, dimana mata pengamat tidak melihat adanya perubahan saat kesetimbangan. Pada kesetimbangan kimia, reaksi tidak berhenti. Reaksi maju dan reaksi mundur terus berjalan secara bersamaan menyebabkan perubahan mikroskopik.

PPT Kesetimbangan Kimia PowerPoint Presentation, free download ID6442863
Suhu. Faktor yang memengaruhi kesetimbangan kimia selanjutnya adalah suhu. Perubahan suhu sistem dapat mengubah nilai konstanta kesetimbangan dan mengakibatkan pergeseran kesetimbangan. Bagaimana suhu mengubah kesetimbangan, berkaitan erat dengan reaksi eksotermik dan reaksi endotermik. Pada reaksi eksotermik, panas dihasilkan sebagai produk.
PPT KESETIMBANGAN KIMIA PowerPoint Presentation, free download ID6320928
Dilansir dari Modul Pembelajaran SMA Kimia Kelas XI oleh Novitalia Ablinda Sari, kesetimbangan kimia mempunyai ciri-ciri: 1. Reaksi berlangsung dua arah dan dalam ruang tertutup. 2. Laju reaksi ke kiri dan ke kanan sama besar. 3. Tidak terjadi perubahan makroskopis tetapi perubahan terjadi secara mikroskopis.

Pada saat kesetimbangan, dalam suatu ruangan 10 liter pad...
Pada kesetimbangan kimia reaksi terus berjalan namun konsentrasi dari reaktan dan produk tidak berubah, begitupula dengan warna, kekentalan, dan sifat fisik lainnya tidak terlihat berubah. 2. Sebutkan contoh reaksi satu arah (irreversible) dan reaksi bolak-balik (reversible) Contoh dari reaksi satu arah (irreversible) adalah reaksi yang hanya.

PPT Kesetimbangan Kimia PowerPoint Presentation, free download ID6442863
Pembahasan. Suatu reaksi mencapai titik kesetimbangan saat laju ke kanan sama dengan laju ke kiri, sehingga pada kondisi ini tidak terjadi perubahan konsentrasi baik reaktan maupun produk, sehingga secara makroskopis (yang ditandai dengan perubahan mol atau konsentrasi) itu tidak terjadi perubahan, sedangkan secara mikroskopis, reaksi terus.

Pengertian Kesetimbangan Kimia Konsep Dasar, Faktor dan Contoh Soal Gramedia Literasi
Dalam keadaan yang setimbang tidak terjadi perubahan secara makroskopis (perubahan dapat diamati dan diukur). Kesetimbangan kimia sifatnya dinamis, artinya reaksi terus berlangsung dalam dua arah yang berlawanan dengan kecepatan yang sama.. (SCN)2+bertambah. Pada kesetimbangan ini adanya penambahan ion Fe3+ dan ion SCN-menyebabkan.

Dalam bejana 1 L terjadi reaksi kesetimbangan sebagai b...
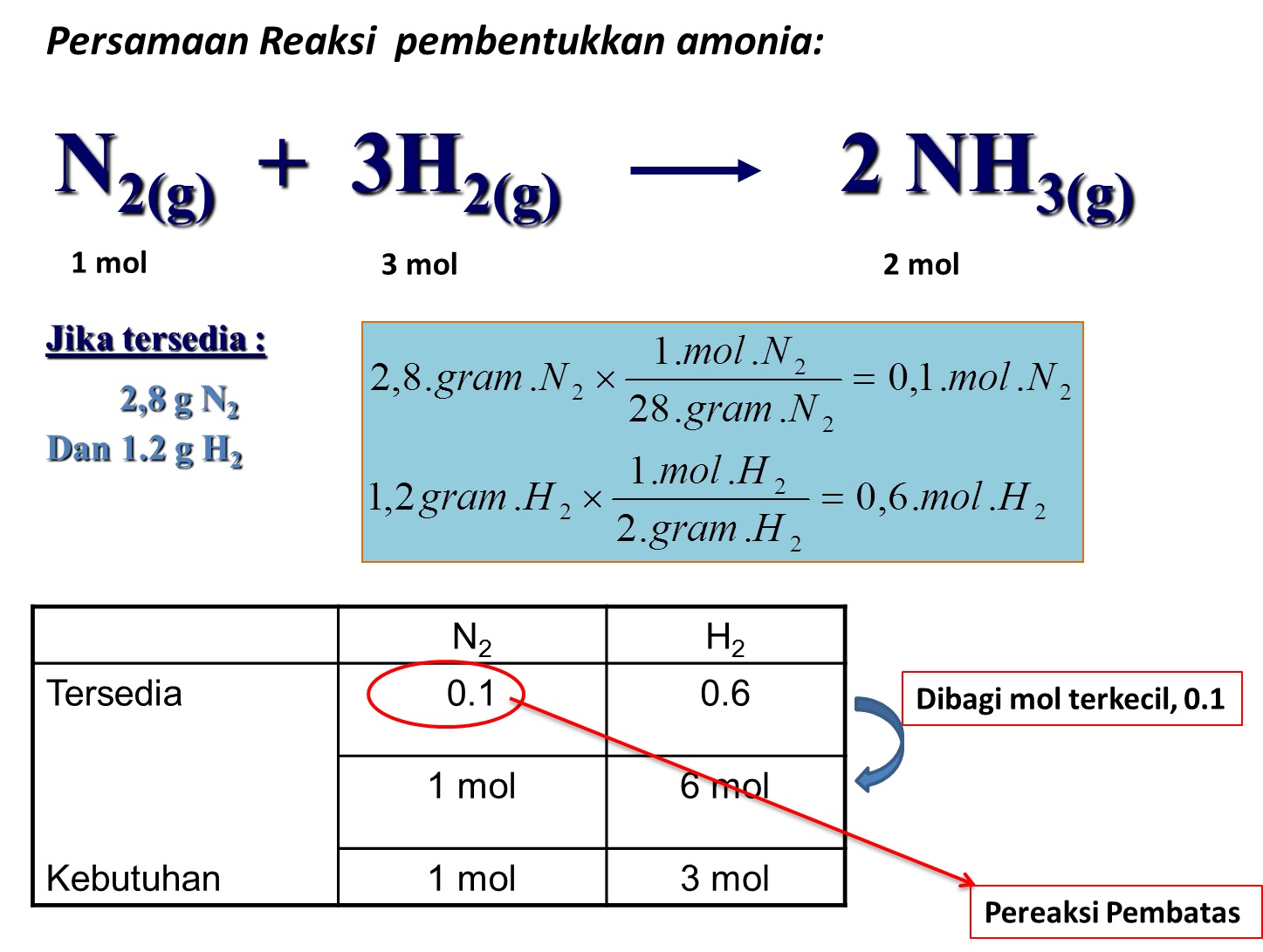
Tuliskan rumusan tetapan kesetimbangan pembentukan amoniak dari gas hidrogen dan gas nitrogen berikut. 3H2(g) + N2(g) ⇌ 2NH3(g) Hitung tetapan kesetimbangan pada soal nomor 2, jika dalam keadaan setimbang (suhu 300°C) 1 Liter campuran gas mengandung 0,15 mol gas hidrogen; 0,25 mol gas nitrogen; dan 0,1 mol gas amoniak.

Berikut ini adalah ciriciri terjadinya reaksi kesetimban...
Tidak terjadi perubahan makroskopis, yaitu perubahan yang dapat diukur atau dilihat. Perubahan mikroskopis (perubahan tingkat partikel) tetap berlangsung.. Ikatan ION lengkap dengan Contoh. Faktor yang Mempengaruhi Kesetimbangan Kimia. Menurut prinsip Le Chatelier, jika terjadi perubahan pada suatu kesetimbangan, maka akan terjadi reaksi.

Kimia Pergeseran Kesetimbangan Akibat Perubahan Tekanan Riset
Oleh karena itu, meskipun tidak terjadi perubahan makroskopis yang dapat diamati, ada perubahan yang terjadi pada tingkat mikroskopis yang menghasilkan kestabilan entropi. 3. Energi Potensial dan Kinetik: Ketika mencapai kesetimbangan, sistem sering memiliki energi potensial dan kinetik yang seimbang.