
Beberapa Bahan Tidak Dapat Menghantarkan Listrik YouTube
Oleh karena itu, arus listrik tidak akan dapat mengalir melalui bahan. Kesimpulannya, lelehan senyawa kovalen polar tidak dapat menghantarkan listrik karena memiliki atom dengan muatan berbeda, ikatan kimia yang kuat, dan partikel-partikel yang tidak dapat bergerak melalui bahan. Jadi, bahan ini tidak dapat digunakan untuk menghantarkan listrik.
Pengertian dan Jenis Ikatan Kovalen
Jadi, senyawa kovalen dapat menghantarkan arus listrik jika dilarutkan dengan air atau pelarut yang benar. Dalam bentuk padat maupun lelehan bersifat nonkonduktor. Senyawa Kovalen Polar: • Padatan: Tidak dapat menghantarkan listrik, karena padatannya terdiri atas molekul-molekul netral meski bersifat polar. • Lelehan: Tidak dapat.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
Ikatan kovalen mempunyai titik leleh dan didih yang rendah. Ikatan kovalen tidak mudah larut dalam air, tetapi bisa larut dalam larutan organik. Ikatan kovalen tidak menghantarkan listrik. Ikatan kovalen berbentuk gas, cairan dan/atau padatan lunak pada suhu ruang. Keadaan ikatan kovalen murni bersifat isolator.

Materi Kimia kelas 10 Ikatan Kovalen Koordinasi dan Penyimpangan Kaidah Oktet _ Struktur SO3
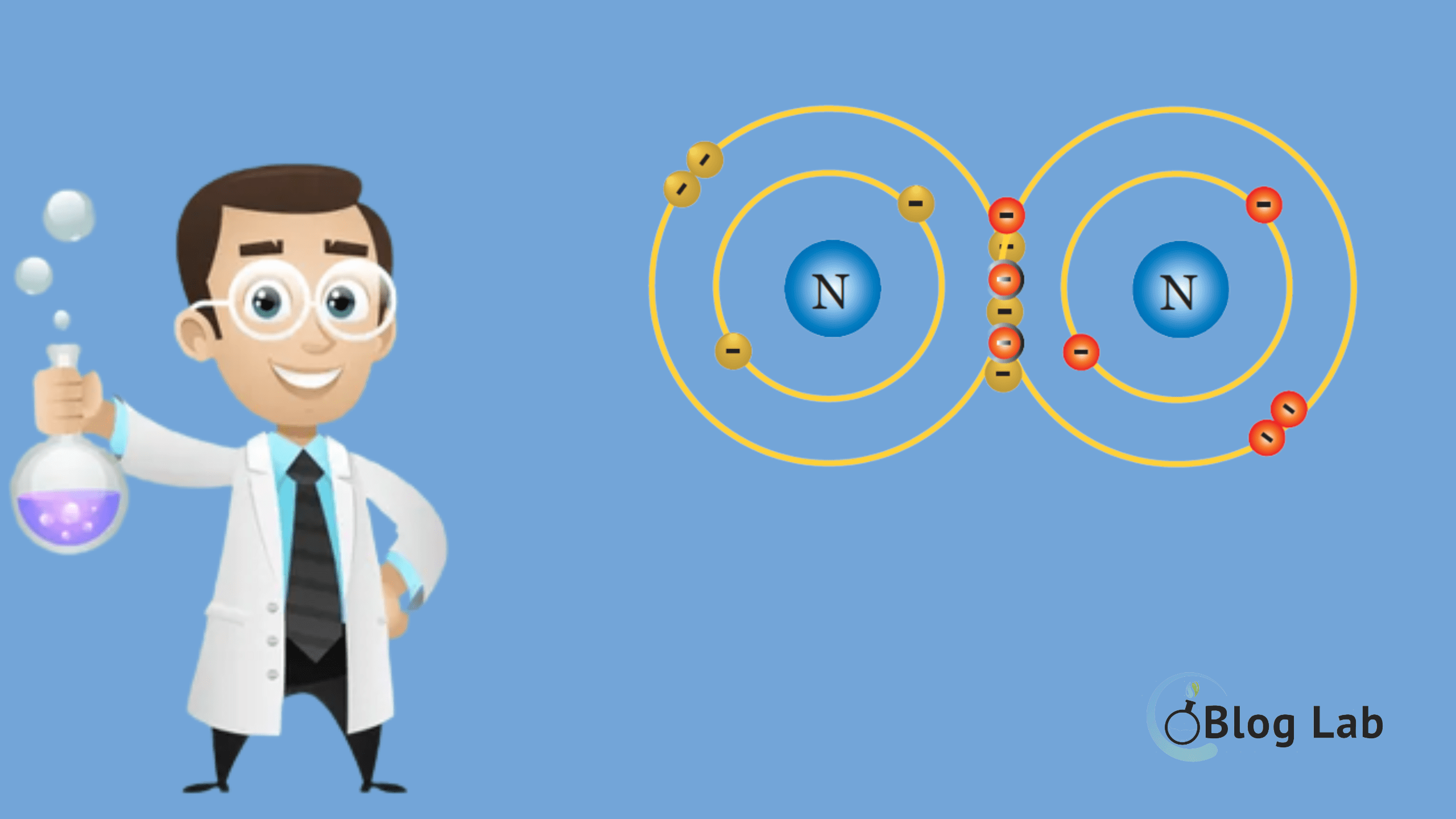
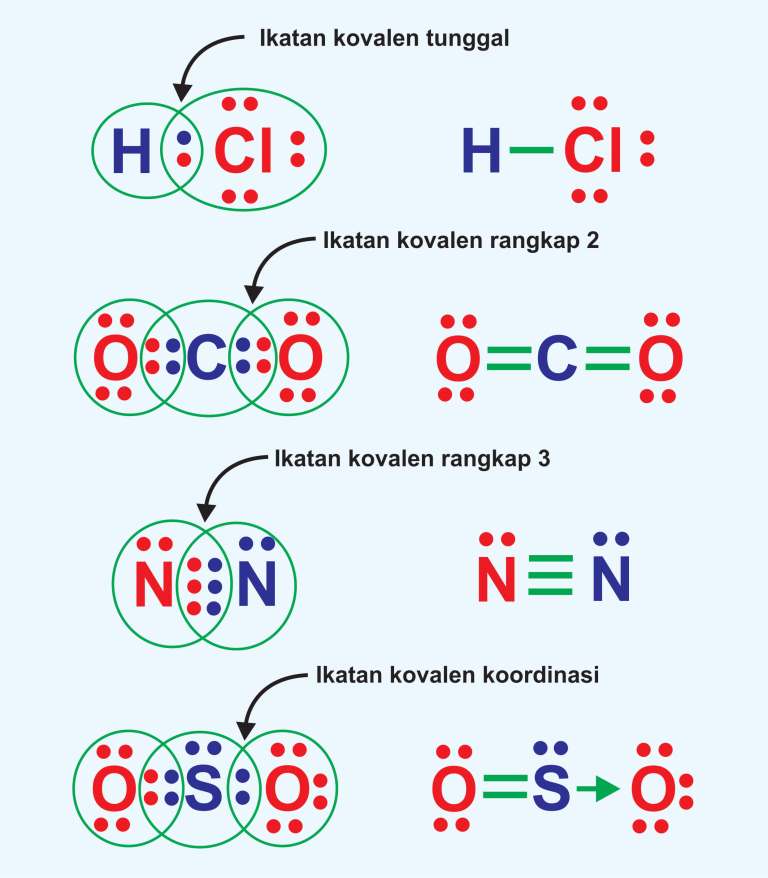
Ikatan kovalen tunggal terjadi ketika dua atom saling berbagi satu pasangan elektron untuk membentuk molekul yang stabil. Ini berbeda dengan ikatan ionik, di mana elektron ditransfer dari satu atom ke atom lain. Pada ikatan kovalen tunggal, kedua atom berkontribusi pada pasangan elektron yang dibagikan sehingga keduanya memperoleh konfigurasi.

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Senyawa kovalen polar murni seperti air suling (hasil destilasi) tidak dapat menghantarkan arus listrik karena kutub positif dan negatif, dipol itu, 'terkunci' dalam molekul oleh ikatan kovalen. You might be interested: Mengapa Kita Harus Mempelajari Akidah Islam?

Perbedaan Ikatan Kovalen Dengan Kovalen Koordinasi My XXX Hot Girl
Pasangan elektron yang berbagi ini dikatakan dalam kondisi terikat, dimana mereka tidak dapat bergerak dari atom satu ke atom lainnya. Oleh karena itu, ikatan kovalen tidak dapat menghantarkan arus listrik. Untuk menjelaskan mengapa ikatan kovalen tidak dapat menghantarkan arus listrik, kita perlu memahami konsep dasar dari arus listrik.
Dasar teori tentang ikatan kovalen
Baca juga: Jenis-jenis Ikatan Kovalen. Daya hantar listrik; Sebagian besar senyawa kovalen memiliki sifat non elektrolit atau tidak bisa menghantarkan arus listrik. Namun, senyawa kovalen polar memiliki sifat elektrolit dan dapat menghantarkan arus listrik dengan baik. Referensi: Hasan, M dan teman-teman. Ikatan Kimia. 2017.

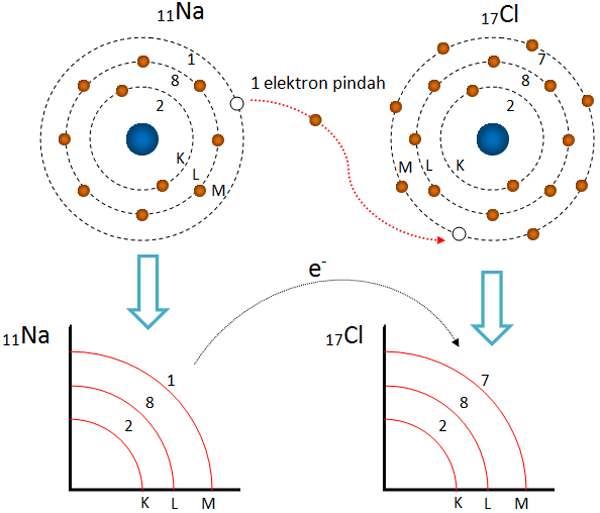
Ikatan Kovalen Dapat Terbentuk Antara Unsur Berbagai Unsur
Kecuali jika ikatan kovalen polar tersebut terputus secara heterolitik (pemutusan ikatan dengan pembagian elektron tidak sembang) hingga membentuk ion positif dan ion negatif, barulah senyawa itu dapat menghantarkan listrik. Misalnya HCl, ini senyawa kovalen polar. Dalam keadaan murni HCl secara teori tidak menghantarkan arus listrik, kecuali.
Contoh Soal Ikatan Ion Dan Kovalen Contoh Soal Terbaru
Lain hal dengan larutan nonelektrolit. Larutan ini tidak dapat menghantarkan arus listrik sehingga tidak dapat menyalakan lampu dan tidak menimbulkan gelembung gas. Larutan nonelektrolit tidak dapat terionisasi dalam air (α = 0).

perbedaan senyawa ion dan kovalen dalam menghantarkan listrik Samantha Edmunds
Meskipun senyawa-senyawa ini memiliki ikatan kovalen polar, mereka tidak menghasilkan ion-ion yang dapat menghantarkan listrik.. H 12 O 6 C_6H_{12}O_6 (glukosa), C 2 H 5 O H C_2H_5OH (etanol). Senyawa-senyawa ini tidak mengandung ion-ion bebas sehingga tidak dapat menghantarkan arus listrik.. (Cl⁻) dalam air, sehingga dapat.
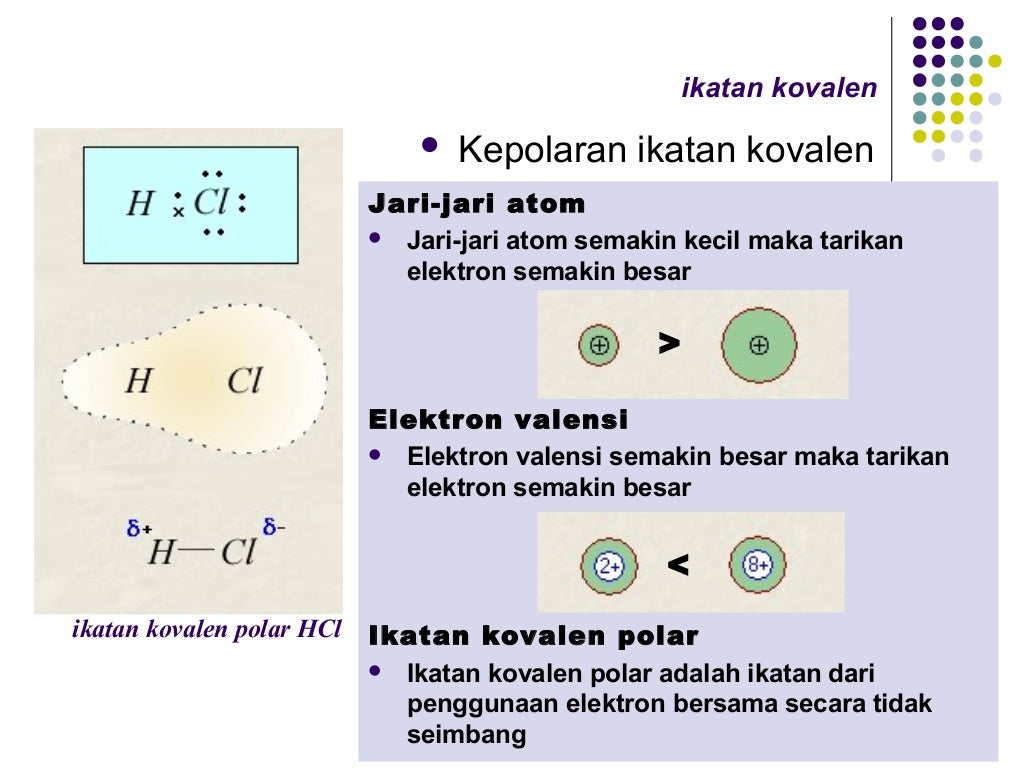
Ikatan kovalen
Pada umumnya, tidak menghantarkan listrik. Berupa cairan, gas, atau padatan lunak pada suhu ruang. Keadaan murni bersifat isolator. Jenis-jenis Ikatan Kovalen . Berikut adalah beberapa jenis ikatan kovalen berdasarkan jumlah pasangan elektron dan kepolarannya. 1. Jenis ikatan kovalen berdasarkan jumlah pasangan elektron
Jelaskan mengapa ikatan kovalen rangkap tiga lebih...
Senyawa kovalen polar dapat menghantarkan arus listrik karena dalam larutannya terionisasi menghasilkan ion-ion bermuatan yang bergerak bebas. Kemampuan suatu larutan dalam menghantarkan arus listrik disebabkan adanya ion-ion bermuatan (kation dan anion) yang bergerak bebas dalam larutannya. Ion-ion ini dihasilkan dari reaksi ionisasi maupun.

Cara Pembentukan Ikatan Kovalen Senyawa NH3 (Amonia) YouTube
Senyawa kovalen terdiri dari molekul-molekul yang memiliki sifat netral dan tidak dapat menghantarkan listrik. Namun, mengapa pada senyawa kovalen HCl mampu menghantarkan listrik? Senyawa kovalen bersifat polar yang terdapat gaya tarik menarik untuk memutuskan ikatan-ikatan tertentu antar molekul. Sehingga, jika dilarutkan dalam air (pelarut.
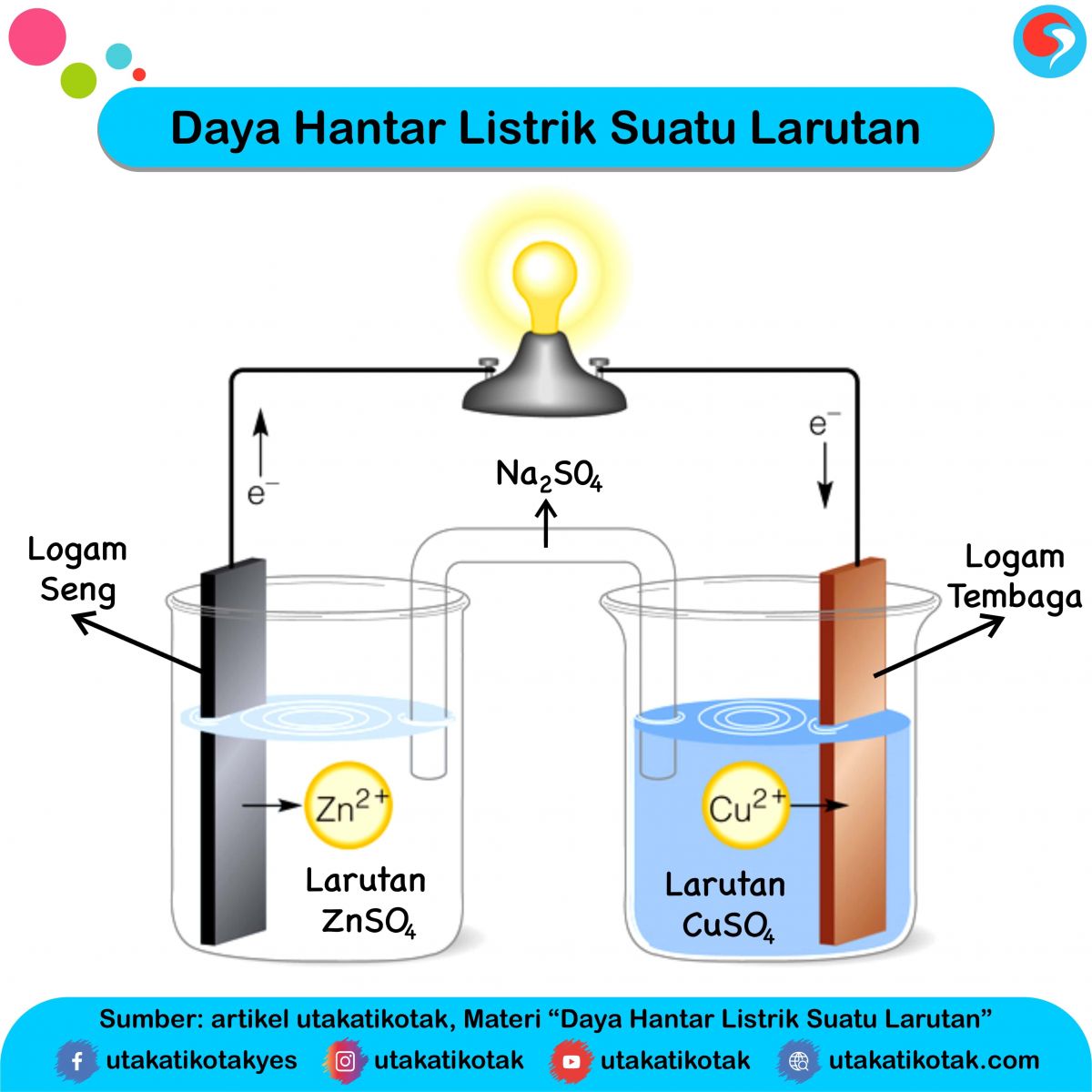
Pasangan Senyawa Mana Yang Dapat Menghantarkan Arus Listrik Dalam My XXX Hot Girl
Tidak dapat menghantarkan aliran listrik juga kecuali pada grafit atau karbon pada batu baterai dan dalam isi pensil. Hal ini menyebabkan ikatan kovalen jadi sangat kuat dan menyebabkan bentuk struktur raksasa yang membuat titik didihnya tergolong cukup tinggi.

Detail Contoh Senyawa Ikatan Kovalen Koleksi Nomer 7
Ikatan kovalen terjadi ketika dua atom saling berbagi elektron untuk mencapai kestabilan. Ikatan kovalen adalah jenis ikatan yang kuat, tapi kenapa tidak dapat menghantarkan arus listrik? Hal ini pasti menjadi pertanyaan yang sering muncul di benak Anda. Pendahuluan. Dalam kimia, ada dua jenis zat yang dapat menghantarkan arus listrik.

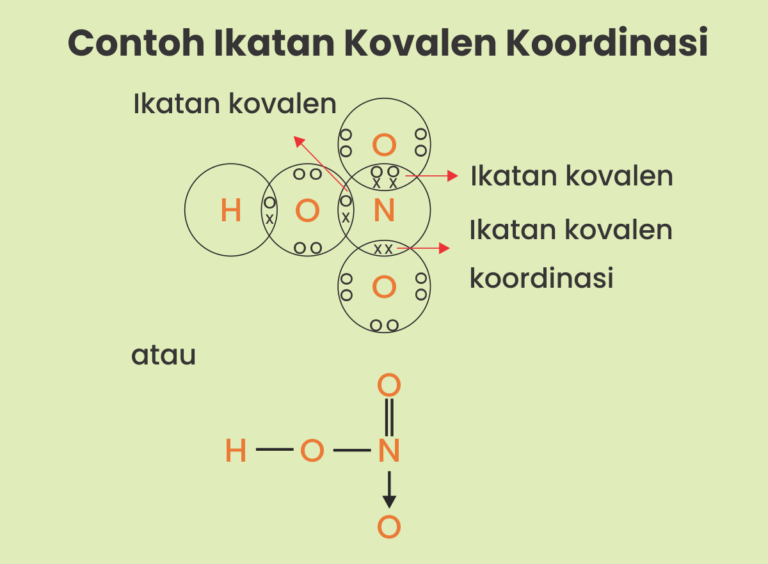
Ikatan Kovalen Koordinasi, Kenali Pengertian dan Contohnya
1). Jenis ikatan yang dimiliki oleh larutan non-elektrolit adalah ikatan kovalen. Mengapa senyawa kovalen tidak dapat menghantarkan listrik? Pembahasan : Karena ketika berada dalam larutan, senyawa kovalen tidak dapat terionisasi. Shg tidak ada ion yang dapat menghantarkan arus listrik. 2).