
Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Senyawa Kompleks dan Penamaannya. Senyawa kompleks adalah senyawa yang tersusun dari atom logam/atom pusat, yang umumnya adalah logam transisi, dengan anion atau ligan yang terikat melalui ikatan koordinasi. Senyawa kompleks ini umumnya ditemui pada logam transisi karena logam tersebut memiliki banyak ruang kosong pada orbital d nya yang dapat.

Contoh Larutan Elektrolit Kuat Lemah Beserta Perbedannya Riset
Karena F$^{-}$ merupakan ligan lemah, kelima elektron d memasuki lima orbital d dengan spin paralel sehingga terciptalah kompleks spin tinggi. Sebalikanya, ion sianida adalah ligan kuat, sehingga secara energi kelima elektron memilih berada pada orbital rendah dan karena itu terbentuklah kompleks spin rendah. Kompleks spin tinggi lebih.

on my world college chemistry (˘ ˘ʃƪ) NAMA DAN JENIS LIGAN BESERTA RUMUS KIMIA
Kekuatan ikatan antara ligan dan ion logam bervariasi, sehingga ligan diklasifikasikan menjadi ligan kuat dan ligan lemah. Ligan Kuat . Memiliki afinitas tinggi terhadap ion logam. Membentuk kompleks logam yang sangat stabil. Biasanya memiliki muatan negatif atau basa Lewis yang kuat. Contoh: CN -, NH 3, en; Ligan Lemah . Memiliki afinitas.

Detail Contoh Elektrolit Kuat Dan Lemah Koleksi Nomer 6
Teori: Interaksi antara ion logam dan ligan merupakan hasil tarik-menarik antara ion logam yang bermuatan positif dan muatan negatif dari elektron ligan yang tidak berpasangan. Teori ini terutama didasarkan pada perubahan yang terjadi pada lima orbital elektron yang terdegenerasi (atom logam memiliki lima orbital d).

Mengapa Warna Ion Kompleks Berbedabeda? Markas Belajar
Ligan adalah atom, ion, atau molekul yang menyumbangkan atau berbagi dua elektronnya melalui ikatan kovalen koordinat dengan atom atau ion pusat. Konsep ligan dibahas di bawah koordinasi kimia. Ligan adalah spesies kimia yang terlibat dalam pembentukan kompleks dengan ion logam. Oleh karena itu, mereka juga dikenal sebagai agen pengompleks.

Kuliah Online Kimia Koordinasi Jenis Jenis Ligan YouTube
Ligan-ligan dari ion kompleks merupakan anion ataupun molekul netral yang menyumbang satu atau lebih atomnya untuk berikatan dengan ion logam sebagai atom pusat dengan ikatan kovalen. Pada pembentukan ion kompleks, orbital dari ligan yang telah terisi, elektronnya berhibridisasi ke orbital ion logam yang masih kosong.
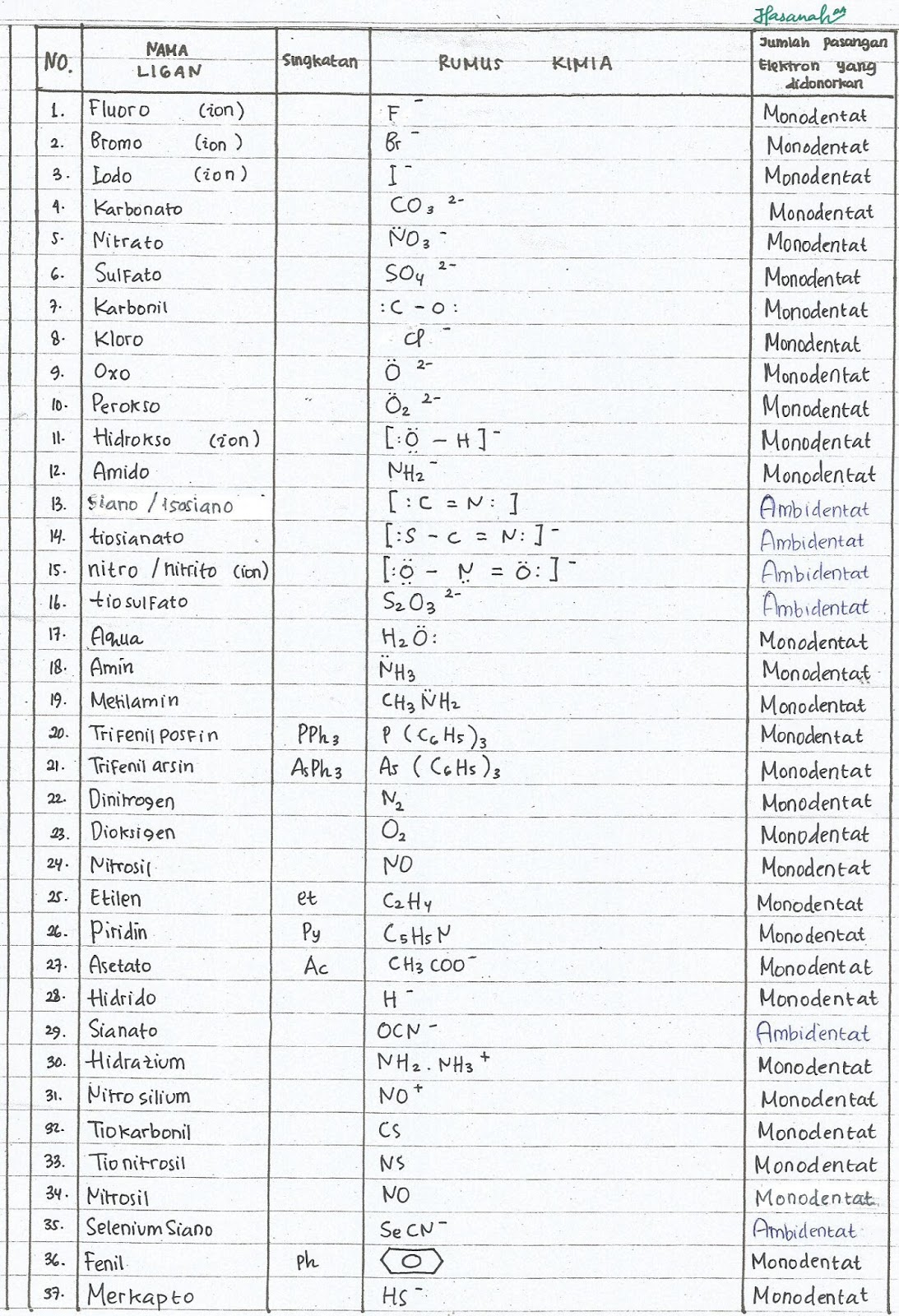
Tabel Ligan
Ligan terbagi atas dua yaitu ligan kuat dan ligan lemah. Ligan kuat dapat mendorong elektron pada orbital d atom pusat untuk berpasangan sedangkan ligan lemah tidak bisa. Pada percobaan ini kekuatan medan ligan yang dibandingkan adalah antara air dan amonia, dimana kedua ligan tersebut merupakan ligan kuat. Sedangkan atom pusat yang digunakan.

GERAKAN KUAT DAN LEMAH / Tema 1 Subtema 2 Pembelajaran 3 Kelas 3 YouTube
Khelasi Khelasi merupakan proses dimana molekul polidentat mengikat ion logam membentuk suatu cincin. Kompleks yang dihasilkan melelui proses ini disebut khelat, dan ligan polidentat disebut sebagai agen khelasi. Contoh ligan yang mampu membuat khelasi adalah EDTA. Di bawah ini merupakan contoh kompleks logam-EDTA. Warna dan Sifat Magnet

Contoh Larutan Elektrolit Kuat Dan Lemah Berbagai Contoh
Ligan yang memiliki ikatan phi yang bisa melakukan donor pasangan elektron phi bonding. Pada Contoh, etilen memiliki yang memiliki orbital kosong disekelilingnya dapat menjadi phi akseptor. Namun yang bisa terjadi jika etilen anti-bonding karena akan cocok berinteraksi dengan atom logam. Hapticity ligand:

12 Contoh Basa Kuat Dan Basa Lemah
Disebut medan ligan kuat (strong ligand field / kekuatan medannya besar) karena perbedaan energi antara orbital t2g (dxy, dxz dan dyz) dengan orbital eg (dx2-y2 dan dz2) besar, akibatnya elektron akan mengisi penuh energi yang rendah sebelum mengisi orbital yang energinya tinggi (pengisian elektron berpasangan terlebih dahulu, kemudian naik ke.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Gambar Stocktrek / Gambar Getty. Ligan adalah atom , ion , atau molekul yang menyumbangkan atau berbagi satu atau lebih elektronnya melalui ikatan kovalen dengan atom atau ion pusat. Ini adalah kelompok pengompleks dalam kimia koordinasi yang menstabilkan atom pusat dan menentukan reaktivitasnya. Ligan biasanya dianggap sebagai basa Lewis.
Daftar Asam Basa Kuat Dan Lemah
yang memiliki ligan kuat, sebaliknya ligan lemah dapat menghasilkan kompleks dengan keadaan spin tinggi. Khusus pada kompleks oktahedral ion besi (II) yang. C - N pyridine, dan C - H aromatic [11]. Ligan 3-bpp memiliki potensi membentuk ikatan hidrogen dengan molekul air ataupun molekul lain yang memiliki atom dengan

asid kuat asid lemah YouTube
Deret spektrokimia (spectrochemical series) adalah urutan yang dihasilkan untuk sejumlah ligan dari yang terlemah sampai yang terkuat. Pengukuran sifat magnetik dan spektrum absorpsi dari kompleks logam transisi dapat memberi peringkat ligan dari yang paling lemah berinteraksi dengan ion logam (dengan demikian memberikan pembelahan medan kristal terkecil) sampai yang berinteraksi paling kuat.
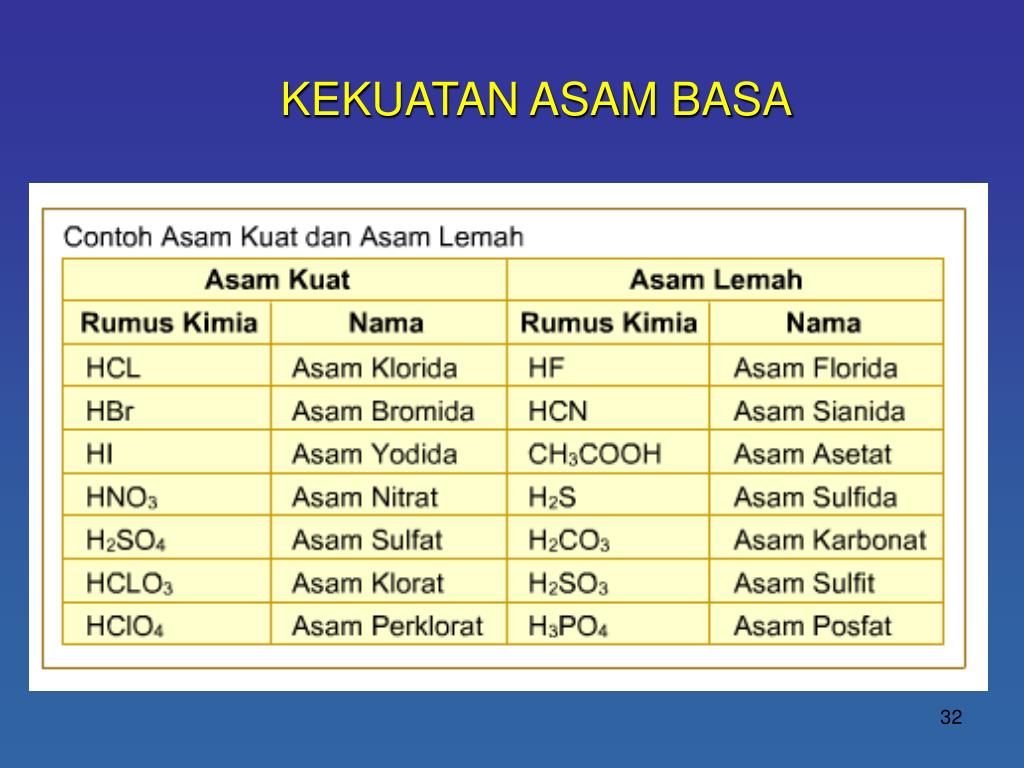
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Aturan 18 elektron tidak berlaku untuk senyawa koordinasi dengan medan ligan yang lemah, seperti ligan bromo atau ion bromin (Br-). Ligan yang lemah akan membuat celah energi (Δ 0) antara orbital t 2g dan e g kecil. Celah energi yang kecil akan membuat orbitan e g melemah dan kompleks dapat memiliki lebih dari 18 elektron. Celah energi yang.

Cara Menghitung CFSE Pada Kompleks Oktahedral Medan Kuat dan Medan Lemah TMK Series 6 YouTube
Hal yang perlu diperhatikan adalah bahwa ikatan "lemah" yang paling kuat dapat lebih kuat daripada ikatan "kuat" yang paling lemah.. Dan juga melakui eksperimen resonansi spin ditemukan bahwa terdapat pemakaian bersama sepasang elektron oleh loga dan ligan. Hal ini berarti terdapat juga interaksi kovalen. Teori ini meruapakan teori paling.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Ligan-ligan yang menyebabkan Δ pemisahan orbital-d yang lebih besar disebut sebagai ligan-ligan medan kuat, seperti CN − dan CO. Senyawa kompleks yang memiliki ligan medan kuat tidak akan menempatkan elektron-elektronnya ke orbital yang berenergi tinggi. Hal ini sesuai dengan asas Aufbau. Kompleks yang demikian disebut sebagai "spin-rendah.