
pratikum laporan pratikum tentang daya hantar listrik dalam larutan
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi. Baca juga.

Top 9 larutan yang dapat menghantarkan listrik adalah larutan 2022
Contoh elektrolit kuat adalah asam sulfat (air aki) dan natrium klorida (garam dapur). Larutan elektrolit lemah, merupakan elektrolit yang punya kekuatan daya hantar listrik lemah, hal ini disebabkan karena hanya sebagian kecil molekulnya saja yang terurai menjadi ion-ion. Nilai α pada larutan ini berada diantara 0 dan 1 (0 < α < 1).

Larutan yang menghantarkan listrik dengan baik mengandung...
Larutan Non-Elektrolit. Larutan Non-elektrolit adalah larutan yang tidak dapat membentuk ion-ion dalam pelarutnya sehingga tidak dapat menghantarkan listrik. Ciri dari larutan ini ketika dilakukan percobaan adalah tidak dapat menyalakan lampu dan tidak menghasilkan gas pada kedua elektrodenya.

Larutan Elektrolit dan Nonelektrolit Berita Bisnis dan Wisata Terkini
Sedangkan larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik (tidak terionisasi). Larutan elektrolit dibagi menjadi 2 macam, yaitu: Elektrolit kuat dapat menghantarkan listrik dengan sangat baik mengalami ionsiasi sempurna. Elektrolit lemah menghantarkan arus listrik dengan buruk mengalami ionisasi sebagian.

Soal Larutan Elektrolit Dan Nonelektrolit Satu Trik
Larutan elektrolit lemah, yakni larutan yang tidak semua molekulnya terionisasi (ionisasi tidak sempurna), sehingga hanya sedikit ion-ion yang dapat menghantarkan listrik. Ciri-Ciri Larutan Elektrolit Lemah. Penghantar listrik yang kurang baik atau lemah; Terionisasi sebagian; Tetapan atau derajat ionisasi (a) 0< a <1
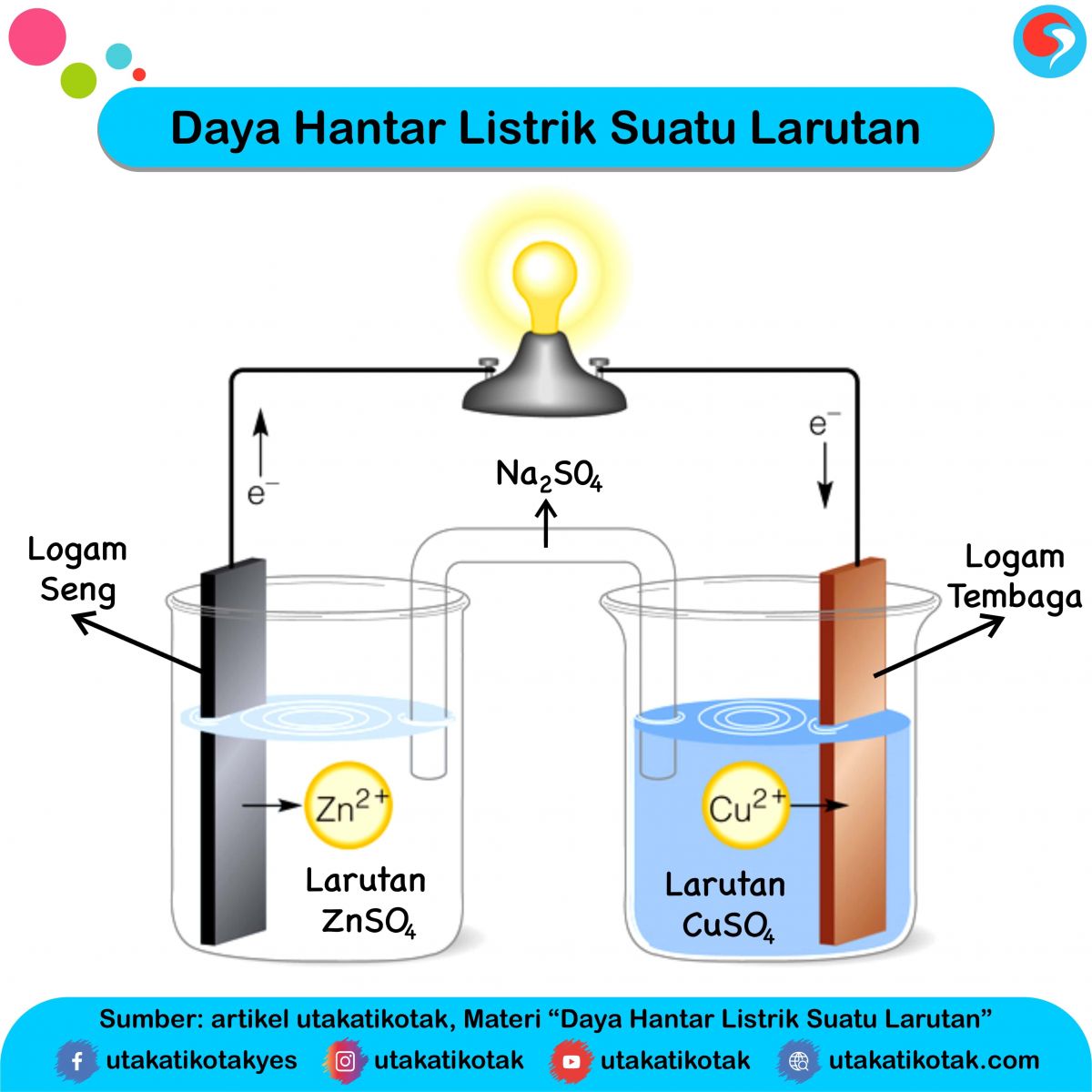
Daya Hantar Listrik Suatu Larutan
Larutan elektrolit kuat dapat menghantarkan arus listrik dengan baik sehingga dapat menyalakan lampu dengan terang dan menimbulkan banyak gelembung gas. Elektrolit kuat dalam air akan terionisasi sempurna dengan derajat ionisasi (α) = 1. α = Jumlah mol zat yang terionisasi / Jumlah mol zat mula-mula. Kelompok larutan elektrolit kuat terdiri.

Spesi kimia yang menghantarkan listrik di dalam larutan K...
Elektrolit merupakan suatu zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang dapat menghasilkan arus listrik. Nonelektrolit adalah tidak dapat menghantarkan arus listrik ketika dilarutkan dalam air. Semakin banyak jumlah ion, semakin kuat daya hantarnya. Sedangkan larutan yang tidak dapat menghantarkan arus listrik disebabkan.
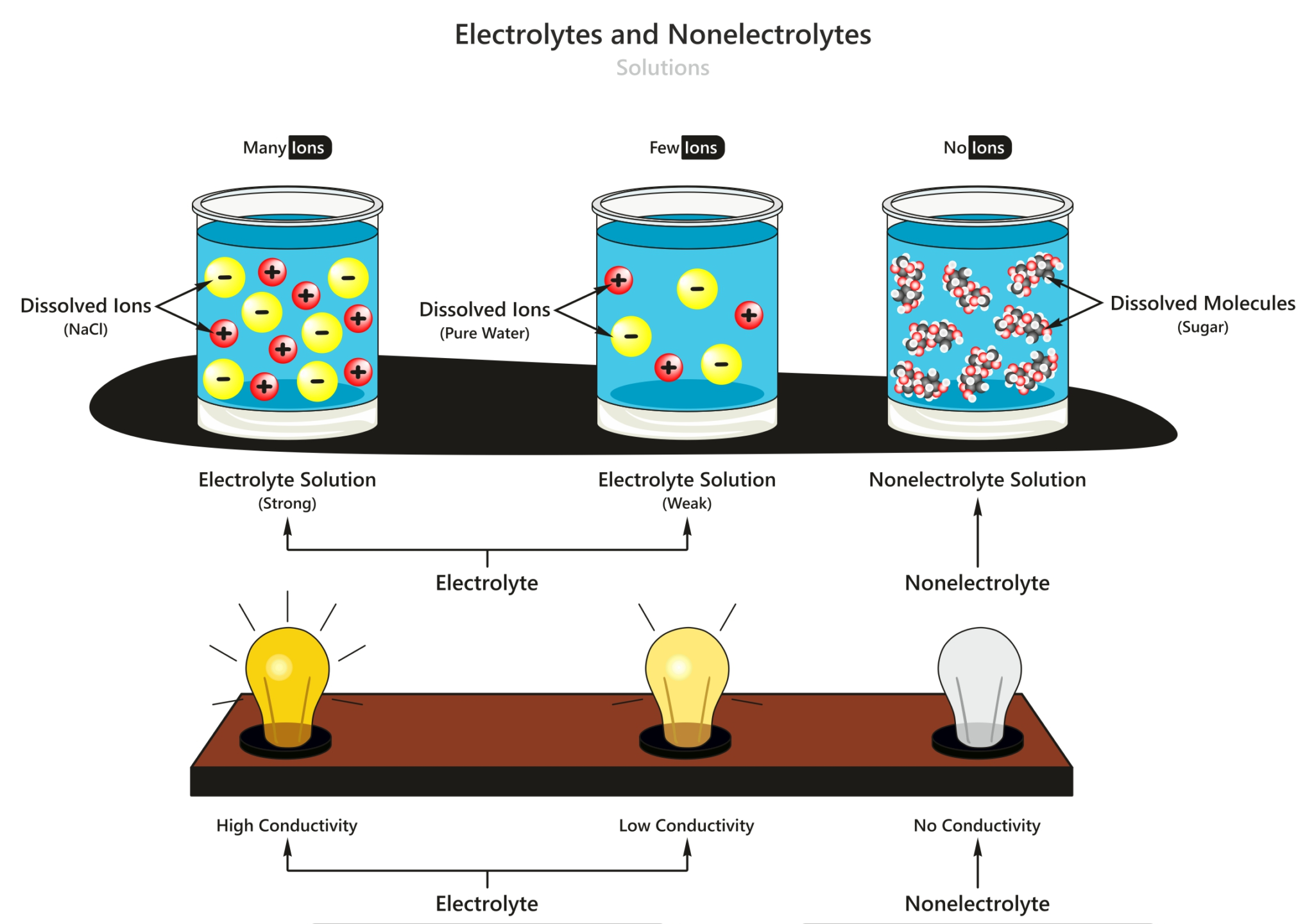
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Berdasarkan daya hantar listrikl, larutan memiliki dua jenis, yaitu: Larutan elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena mengalami reaksi ionisasi, yaitu reaksi pembentukan ion-ion. Semua larutan anorganik, baik asam, basa, maupun garam memiliki sifat menghantarkan arus listrik.

Larutan Yang Dapat Menghantarkan Arus Listrik Disebut PDF
Seperti namanya, larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Jika disekitar penghantar listrik (electrode) tidak muncul gelembung-gelembung gas, dan lampu tidak menyala ketika diuji. Ciri-ciri dari larutan non-elektrolit: Pada larutan non elektrolit, senyawa dalam air tidak mengalami proses ionisasi.
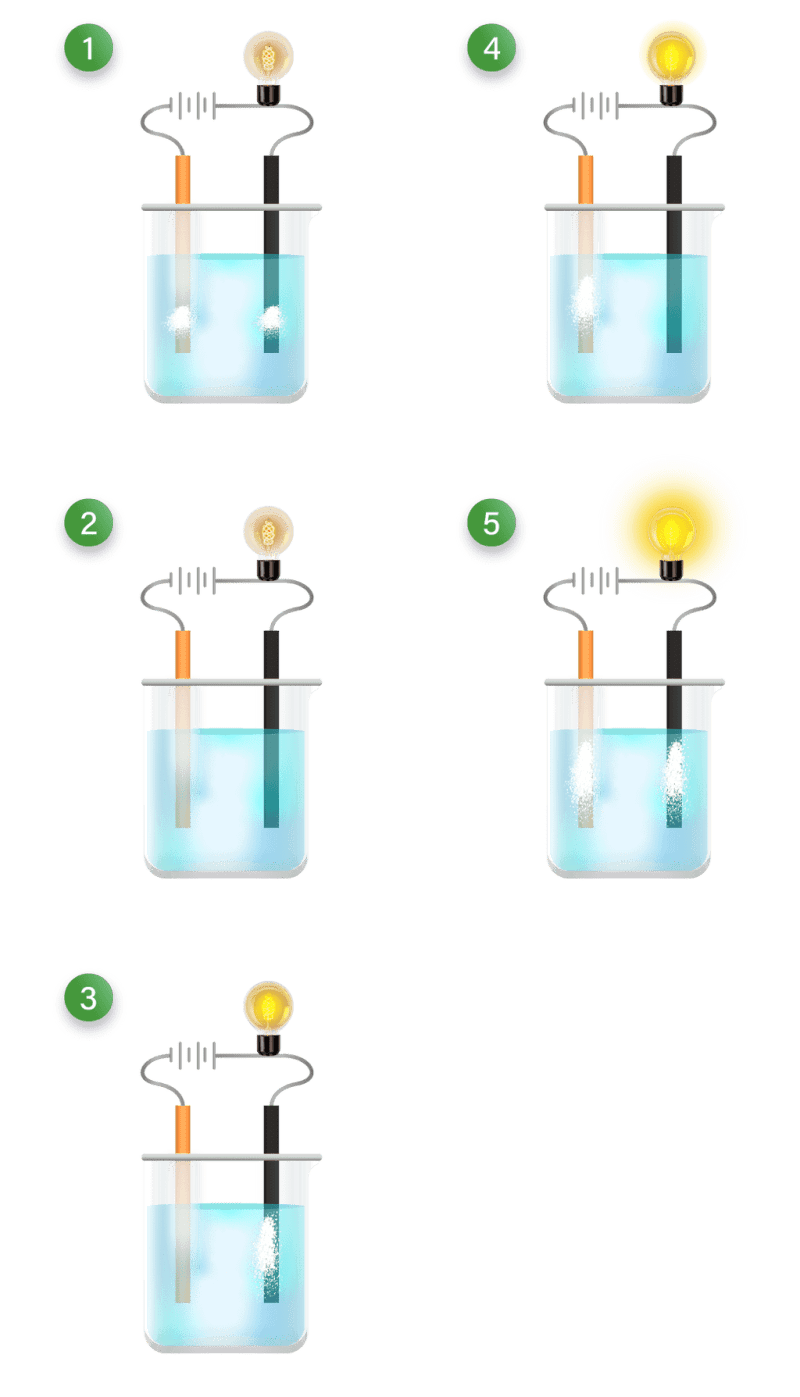
Pasangan Larutan Berikut Yang Dapat Menghantarkan Arus Listrik Adalah YPHA.OR.ID
Larutan non-elektrolit adalah jenis larutan yang tidak mampu menghantarkan arus listrik karena tidak menghasilkan ion-ion yang bergerak bebas. Dalam kategori ini, senyawa-senyawa penyusun larutan tetap utuh sebagai molekul-molekul dalam bentuknya yang tidak terionisasi. Senyawa Kovalen Polar

Larutan elektrolit & non elektrolit
Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl (asam klorida), dan KCl, yang semuanya juga termasuk elektrolit kuat.

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Larutan elektrolit adalah larutan yang dapat menghantarkan listrik,. Senyawa kovalen polar ada yang dapat mengalami ionisasi bila dilarutkan dalam air, sehingga membentuk ion-ion bebas yang dapat menghantarkan listrik misalnya HCl, H 2 SO 4, H 2 C 2 O 4, CH 3 COOH, dan NH 3. Senyawa-senyawa tersebut merupakan zat elektrolit.

Larutan Yang Mempunyai Daya Hantar Paling Besar Adalah Lengkap
Dalam padatan senyawa ion tidak dapat menghantarkan listrik karena ion-ionnya tidak dapat bergerak bebas sedangkan dalam lelehan atau larutan, senyawa ion akan membentuk ion-ion yang dapat menghantarkan listrik karena mengalami ionisasi sempurna. Contoh: $\mbox{NaCl}$, $\mbox{Li}_{2}\mbox{O}$ dan lain-lain. 3. Senyawa kovalen. a. Asam. Dalam.

MENGUJI LARUTAN MANA KAH YANG BISA MENGHANTARKAN LISTRIK YouTube
Biasanya, larutan yang dapat menghantarkan listrik adalah larutan yang mengandung ion, yaitu atom atau molekul yang memiliki muatan listrik. Ketika larutan bereaksi dengan komponen kimia lainnya, ia dapat menghasilkan ion. Ion-ion ini kemudian dapat bergerak di antara molekul larutan, dan ini memungkinkan arus listrik untuk mengalir melalui.

30 Contoh Larutan Elektrolit dan Non Elektrolit
Biasanya, elektrolit adalah senyawa dengan ikatan ionik yang mudah terdisosiasi dan bukan merupakan ikatan kovalen yang memiliki resistansi tinggi terhadap arus listrik. Namun, ada beberapa senyawa kovalen polar yang merupakan larutan elektrolit penghantar listrik. Baca juga: Perbedaan Elektrolit Kuat dan Lemah. Contoh larutan yang dapat.

Senyawa Kovalen Polar Yang Dapat Menghantarkan Arus Listrik Adalah Larutan Elektrolit Dan Non
Larutan elektrolit dapat menghantarkan arus listrik karena ion-ion yang terkandung di dalamnya. Berikut adalah proses bagaimana larutan elektrolit dapat menghantarkan listrik! Disosiasi molekul menjadi ion. Dilansir dari Lumen Learning, elektrolit adalah setiap garam atau molekul yang ion-ionnya dapat terdisosiasi jika dilarutkan dalam air.