Apa Itu Tekanan Osmotik dan Bagaimana Prosesnya? Kimia Kelas 12 Belajar Gratis di Rumah
Tentukan tekanan osmotik larutan glukosa 0,03 M pada suhu 29°C. Jawab : π = MxRxT. 0,03M x 0,082 Latm mol/K x (29+273) K. =. 0,74atm. Maka, tekanan osmotik larutan glukosa tersebut yaitu 0,74 atm. Contoh Soal 2. Sebuah larutan terbuat dari 1,14 g sukrosa (C12H22O11) dengan massa molekul relatif 342 yang dilarutkan ke dalam air yang volumenya.

Contoh Soal Un Sifat Koligatif Larutan Dan Pembahasannya / Rumus Tekanan Osmotik / Gambar yang
molaritas larutan. tetapan gas. suhu. faktor Van't Hoff. jumlah ion. Larutan dengan konsentrasi sama yang memiliki tekanan osmotik terbesar adalah larutan elektrolit karena terdapat faktor Van't Hoff. Larutan nonelektrolit contohnya adalah , , , , dan lainnya. Larutan elektrolit contohnya adalah . Jadi, jawaban yang benar adalahE.
Penurunan tekanan uap larutan disebabkan oleh
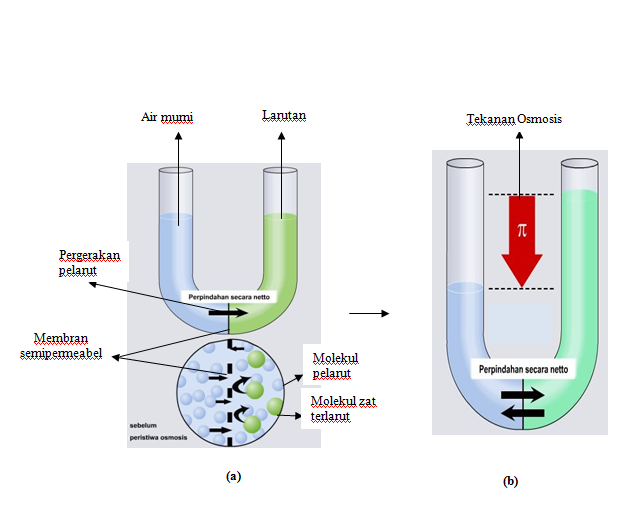
Larutan dengan larutan terlarut yang lebih sedikit akan mempunyai tekanan osmotik yang lebih rendah disebut sebaagai"hipotonik" pada yang lain (dari bahasa Yunani yang berarti "bawah.") Jika kedua larutan memiliki jumlah partikel terlarut yang sama maka, osmotik sama. tekanan-mereka dikatakan isotonik satu sama lain.

Larutan 0,02 M berikut yang mempunyai tekanan osmotik ter...
Berapakah tekanan osmotik larutan yang dibuat dengan menambahkan 13,65 g sukrosa (C 12 H 22 O 11) ke dalam air yang cukup untuk membuat 250 mL larutan pada 25 °C? Solusi: Osmosis dan tekanan osmotik terkait. Osmosis adalah aliran pelarut ke dalam larutan melalui membran semipermeabel. Tekanan osmotik adalah tekanan yang menghentikan proses.

SKL TEKANAN OSMOTIK LARUTAN YouTube
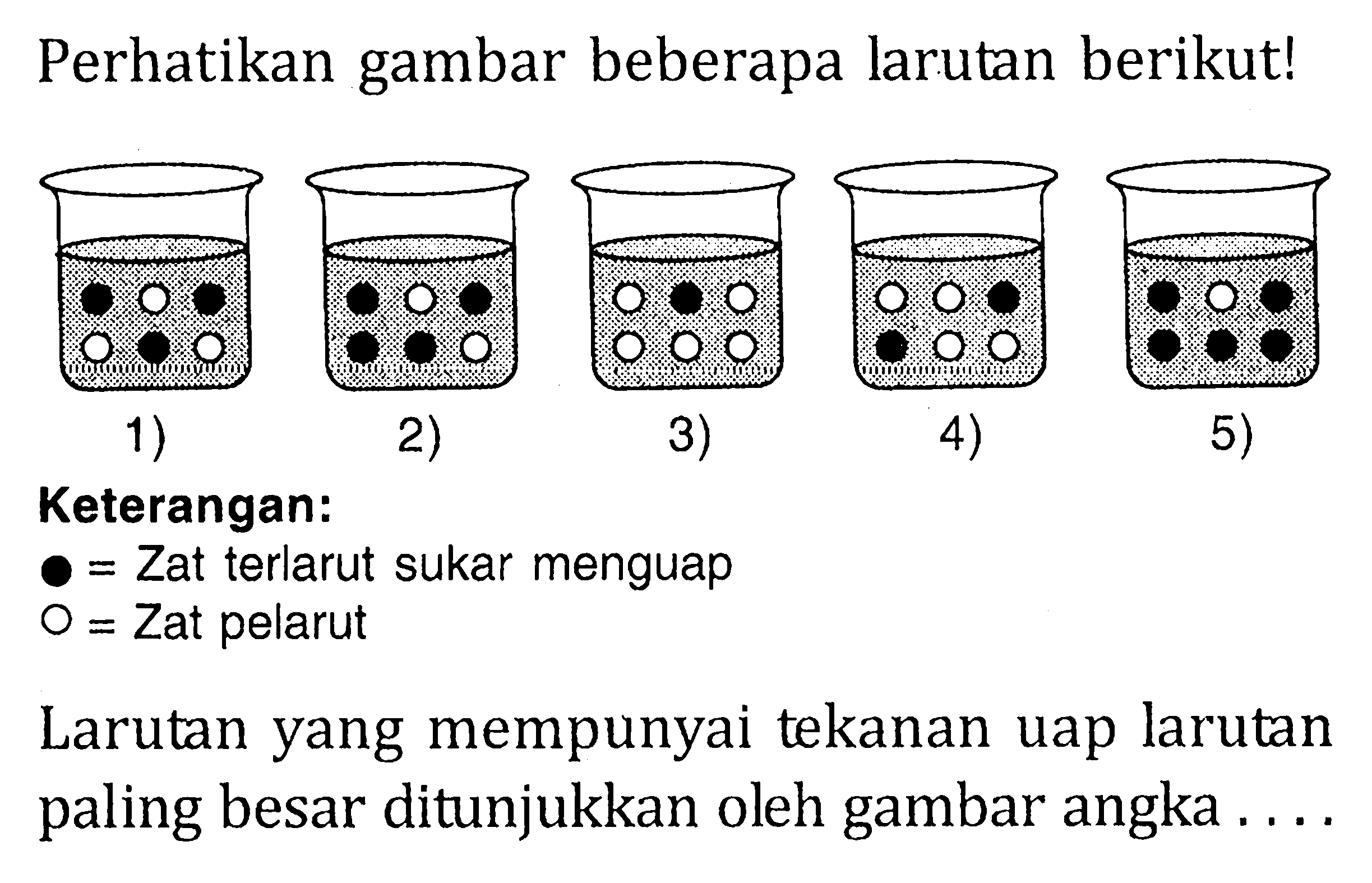
Pembahasan. Untuk menentukan tekanan osmotik suatu larutan non-elektrolit, dapat digunakan persamaan berikut. Tekanan osmotik sebanding dengan molaritas (M). Larutan yang memiliki tekanan osmotik paling besar adalah larutan dengan molaritas terbesar. Molaritas dapat ditentukan dengan persamaan berikut. Penentuan molaritas larutan nomor 4.

Bagan Yang Menunjukkan Tekanan Uap Larutan Paling Besar Adalah Terbaru
Apabila volume semua larutan tersebut dianggap sama, larutan yang mempunyai tekanan osmotic paling kecil adalah larutan nomor.. (R = 0,082 L atm mol -1 K -1 , suhu tetap) 1
Tekanan osmosis larutan Pelajaran Kimia
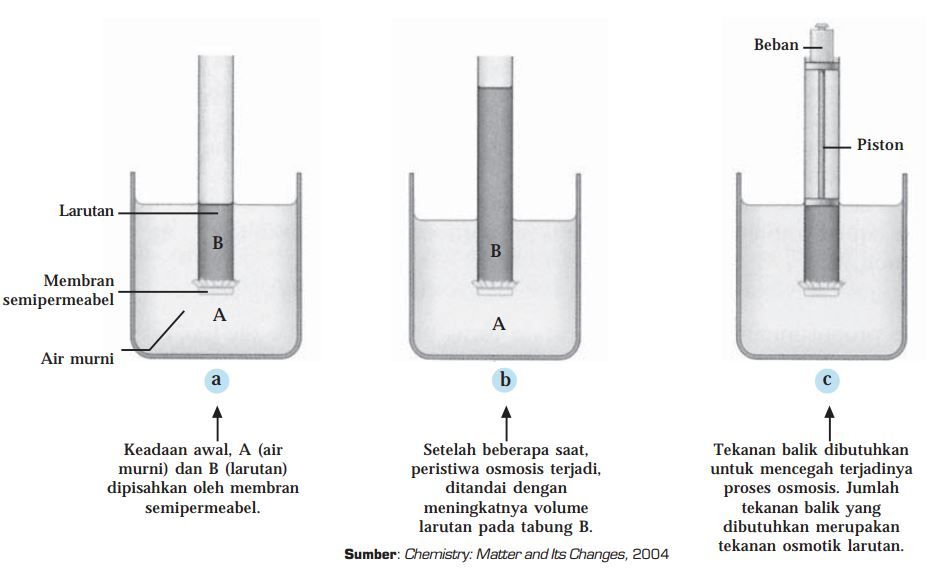
Tekanan osmotik akan mempertahankan kesetimbangan osmotik pada larutan A dan B. Namun, kondisi pada gambar (b) bisa dikembalikan lagi ke keadaan awal seperti pada gambar (a). Caranya adalah dengan memberikan tekanan luar yang besarnya sama dengan tekanan osmotiknya, seperti terlihat pada gambar (c). Nah, setelah memahami apa itu tekanan osmotik.

Cara mudah Menentukan tekanan uap jenuh paling besar dari gambar kimia SMA YouTube
4. Pengolahan air limbah. Penerapan tekanan osmotik selanjutnya adalah pengolahan pada air limbah. Sebagaimana yang diketahui, air limbah yang mengandung banyak zat-zat pencemar lingkungan. Oleh karena itu, air limbah perlu dihubungkan dengan cairan yang bersifat hipertonik melalui membran yang disebut semipermeable.

Apa Itu Tekanan Osmotik dan Bagaimana Prosesnya? Kimia Kelas 12
Langkah Menghitung Tekanan Osmotik. Perhitungan tekanan osmotik larutan apa pun dapat diringkas dalam langkah-langkah berikut: Langkah 1: Ekstrak data dari pernyataan dan lakukan transformasi unit yang diperlukan. Langkah 2: Tentukan jenis zat terlarut atau zat terlarut dan nilai koefisien atau faktor van't Hoff.

Jika Diketahui Tekanan Osmotik Larutan 10
Jawaban paling sesuai dengan pertanyaan Perhatikan tabel berikut: Larutan yang memiliki tekanan osmotik paling besar adalah nomor

Contoh Soal Tekanan Osmosis (Sifat Koligatif Larutan Non Elektrolit) YouTube
Jadi tekanan osmotik larutan tersebut adalah 15,25 atm.. Berdasarkan hal tersebut, maka larutan yang memiliki tekanan uap paling tinggi adalah larutan dengan nomor (2), karena pada nomor (2) partikel zat terlarutnya paling sedikit, sehingga akan banyak partikel pelarut yang menguap sehingga menghasilkan tekanan uap yang paling besar.

Tekanan Osmotik Larutan Kimia Kelas XII YouTube
Tekanan Osmotik: Pengertian dan Contoh Soalnya. Ilustrasi bagaimana tekanan osmotik menghentikan osmosis pada larutan hipertonis dan hipotonik (chem.libretexts.org) KOMPAS.com - Larutan merupakan zat cair yang memiliki zat terlarut di dalamnya. Zat terlarut tersebut menghasilkan sifat koligatif larutan, salah satunya adalah tekanan osmotik.

Tekanan Osmotik Yang Dihasilkan Oleh Protein Disebut Berkas Soalku
Artinya, larutan yang akan memiliki tekanan osmotik paling tinggi adalah larutan dengan nilai faktor van't Hoff paling besar. Secara matematis, faktor van't Hoff dirumuskan: Berdasarkan persamaan tersebut, untuk larutan elektrolit kuat i = n, sedangkan untuk larutan nonelektrolit i = 1.. Di antara larutan 0,01 M di bawah ini, yang mempunyai.

Bagan berikut menggambarkan larutan dengan berbagai konse...
Larutan 1. Pembahasan: Larutan yang memiliki tekanan uap paling tinggi adalah larutan dengan penurunan tekanan uap paling kecil. Oleh karena itu, nilai fraksi mol pun zat terlarut juga harus yang paling kecil. Larutan 1 hanya memiliki 0,2 mol zat terlarut, paling kecil di antara keempat larutan. Contoh Soal 5. Menurut tabel pada soal nomor 4.

KOLIGATIF LARUTAN [ Tekanan Osmotik/Osmosis (π) ] YouTube
Rumus Tekanan Osmotik beserta Contoh Soal dan Pembahasannya. Menyajikan informasi terkini, terbaru dan terupdate mulai dari politik, bisnis, selebriti, lifestyle dan masih banyak lagi. Ilustrasi larutan yang dapat dihitung tekanan osmotiknya. Foto: Pixabay. Larutan memiliki sifat koligatif yang hanya dipengaruhi oleh jumlah partikel zat terlarut.

√ 20 Contoh Soal Tekanan Osmotik Larutan & Pembahasannya PDF
Pengertian Tekanan Osmotik, Rumus, Manfaat, dan Contohnya. Oleh Aji Pangestu Diposting pada 30 Januari 2022. Tekanan osmotik adalah suatu persitiwa yang termasuk ke dalam sifat koligatif dari larutan. Sifat larutan ini dimanfaatkan dalam kehidupan sehari hari seperti dalam bidang medis bahkan hingga bidang industri makanan yang juga menerapkan.