
Contoh Soal Molalitas dan Fraksi Mol larutan LABORATORIUM SMK
Agar lebih paham mengenai fraksi mol, simak penjelasannya berikut ini. Pengertian Fraksi Mol. Fraksi mol merupakan besaran konsentrasi larutan yang menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol larutan. Fraksi mol tidak mempunyai satuan, sehingga ditulis dengan X. Contohnya, fraksi mol urea 01 ditulis dengan X urea 0,1.

Soal Larutan berikut yang mempunyai fraksi mol terbesar adalah
Larutan berikut yang mempunyai fraksi mol terbesar adalah.. Larutan urea 10% (Mr = 60) Larutan glukosa 20% (Mr = 180) Larutan NaCl 10% (Mr = 58,5). Fraksi mol etanol (Mr = 46) dalam larutan etanol 46% massa adalah.. 0,025. 0,075. 0,25. 0,75. 1,00. 14. Multiple Choice. Edit. 2 minutes. 1 pt.

Soal Larutan berikut yang mempunyai fraksi mol terbesar adalah
Fraksi mol menunjukkan komposisi zat di dalam suatu campuran. Jika diasumsikan semua larutan memiliki massa 100 g, maka: A. Larutan Urea 10%, mengandung 10 g Urea dan 90 g Air

Larutan dengan pelarut air berikut memiliki fraksi mol ya...
Pengertian Fraksi Mol. Fraksi mol adalah besaran konsentrasi larutan. Fraksi mol menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol larutan. Fraksi mol tidak memiliki satuan, sehingga dinotasikan dengan X. Contohnya fraksi mol urea 01, ditulis dengan X urea 0,1. Artinya, larutan yang mengandung 0,1 bagian mol urea dalam 1.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30.

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Fraksi mol menunjukkan komposisi zat di dalam suatu campuran. Jika diasumsikan semua larutan memiliki massa 100 g, maka: A. Larutan Urea 10%, mengandung 10 g Urea dan 90 g Air B. Larutan Glukosa 20%, mengandung 20 g Glukosa dan 80 g Air C. Larutan NaCl 10%, mengandung 10 gram NaCl dan 90 gram Air D. Larutan sukrosa 30%, mengandung 30 gram sukrosa dan 70 gram Air E. Larutan 20%, mengandung 20.

Zat berikut yang memiliki jumlah mol terbesar adalah....
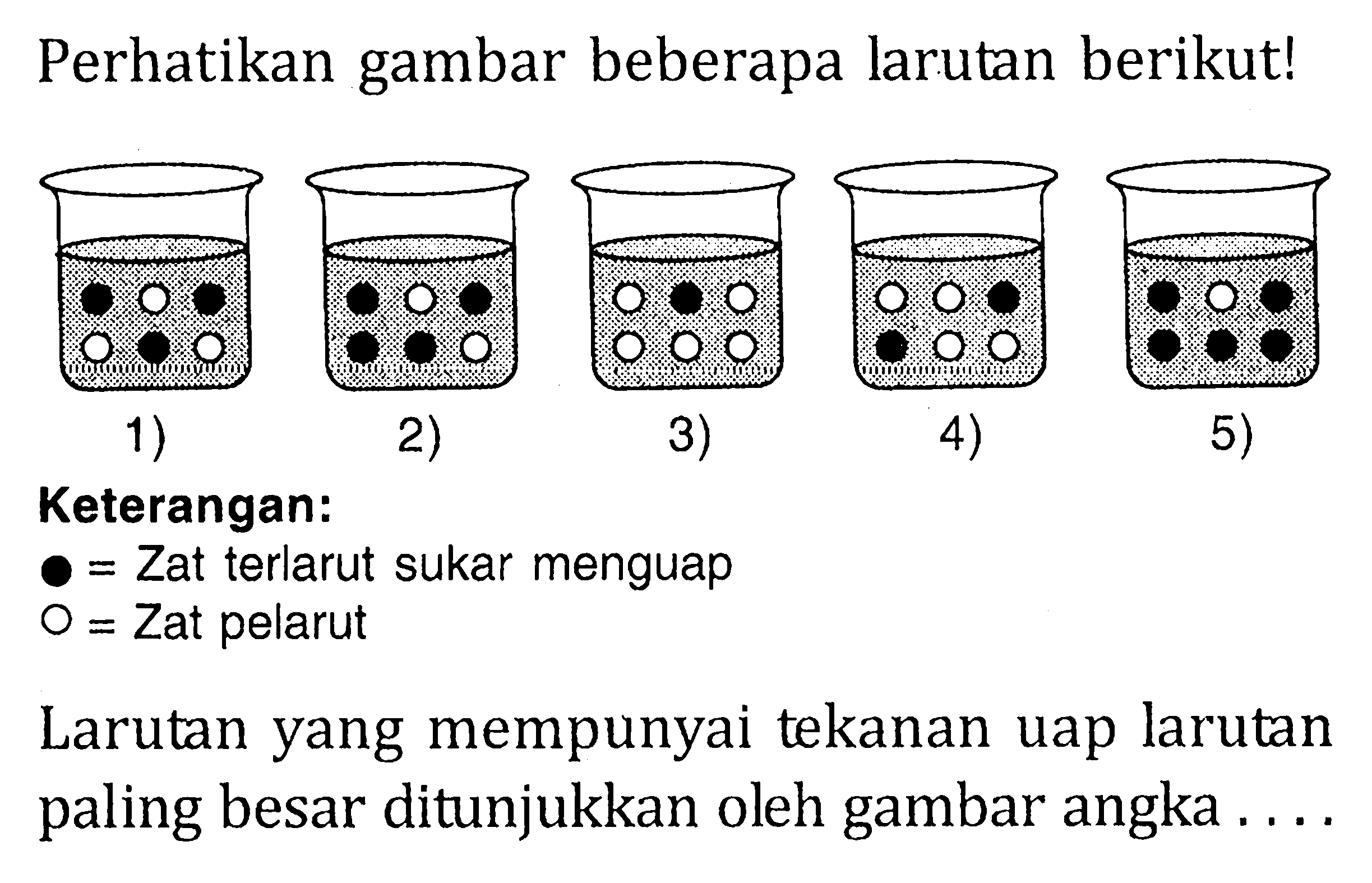
Larutan yang memiliki tekanan uap paling besar adalah larutan yang memiliki fraksi mol pelarut paling besar. Dari gambar pada soal, larutan yang memiliki perbandingan zat pelarutdan zat terlarut paling besarterdapat pada larutan nomor 3). Jadi, larutan yang mempunyai tekanan uap larutan paling besar ditunjukkan oleh gambar angka 3).

Soal Fraksi Mol Sinau
Maka: mol MgSO₄ = 20 gram / 120 = 0,1667 mol mol pelarut (air) = 80 gram / 18 = 4,4444 mol Fraksi mol MgSO₄ = 0,1667 mol / (0,1667 mol + 4,4444 mol) Fraksi mol MgSO₄ = 0,1667 mol / 4,6111 mol Fraksi mol MgSO₄ = 0,0361 D. Larutan NaCl 10% (Mr = 58,5) Kandungan NaCl adalah 10 % misalkan adalah 10 gram maka kandungan pelarutnya adalah 90%.

fraksi mol natrium hidroksida(Mr 40)suatu larutan
x air = 5 / (0,1 + 5) x air = 0,9804. x garam juga dapat dihitung dengan rumus. x air = 1 - x garam. x air = 1 - 0,0196. x air = 0,9804. Jadi fraksi mol garam dapur adalah 0,0196 & fraksi mol air adalah 0,9804. Demikian penjelasan lengkap tentang rumus perhitungan mol, Molaritas, Molalitas, Normalitas, dan Fraksi Mol Larutan. Semoga.

Kumpulan Contoh Soal Fraksi Mol dan Pembahasannya Terbaru 2022 Halaman 4
5. Fraksi mol natrium hidroksida suatu larutan NaOH dalam air adalah 0,05. Kemolalan larutan natrium hidroksida adalah. Jawaban:-Fraksi mol NaOH = 0,05-Fraksi mol air = 1 - 0,05 = 0,96-Mr air = 18 molalitas = 0,05 x 1.000 = 2,92 0,95 x 18. Detikers, sudah paham kan pengertian dan contoh soal fraksi mol? Selamat belajar ya!

Larutan berikut yang memiliki fraksi mol ter kecil adala...
Satuan Konsentrasi Larutan; Larutan berikut yang mempunyai fraksi mol terbesar adalah . . . . A. larutan urea 10% (Mr = 60) B. larutan glukosa 20% (Mr = 180) C. larutan NaCl 10% (Mr = 58,5) D. larutan sukrosa 30% (Mr = 342) E. larutan MgSO4 20% (Mr = 120) Satuan Konsentrasi Larutan; Sifat Koligatif Larutan; Kimia Fisik dan Analisis

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Fraksi mol adalah satuan konsentrasi yang didefinisikan sebagai kesetaraan dalam jumlah mol komponen dibagi dengan jumlah total mol larutan. Karena itu adalah proporsi, fraksi mol adalah besaran tanpa satuan. Fraksi mol semua komponen larutan, ketika ditambahkan bersama-sama, akan sama dengan 1 dan dianggap sebagai satuan konsentrasi tanpa dimensi.

Contoh Soal Fraksi Mol Dan Pembahasannya
Agar lebih memahami tentang pengertian dan rumus fraksi mol, maka sebaiknya berlatih soal adalah hal yang paling ampuh, dibawah ini contoh - contoh soal fraksi mol lengkap dengan pembahasannya. Contoh Soal 1. Sebuah larutan terdiri dari 3 mol zat A, 3 mol zat B, dan 4 mol zat C. Hitung fraksi mol dari masing - masing zat tersebut ? Pembahasan :
Perhatikan grafik berikut! Jika jumlah mol partikel pelar...
Adapun persamaan fraksi mol adalah sebagai berikut. Keterangan: X t = fraksi mol zat terlarut; X p = fraksi mol pelarut; n t = mol zat terlarut; dan. n p = mol zat pelarut. 8. Pengenceran. Untuk mengurangi tingkat kepekatan suatu larutan, Quipperian bisa melakukannya dengan menambahkan air. Metode ini dikenal sebagai pengenceran. Larutan yang.

Larutan Berikut Yang Memiliki Fraksi Mol Terkecil Adalah
Fraksi mol adalah perbandingan antara jumlah zat suatu komponen (bisa pelarut maupun zat terlarut) dan jumlah zat total atau mol zat totalnya. Mol zat total meliputi mol pelarut dan mol zat terlarut. Di dalam Kimia, penentuan fraksi mol merupakan hal yang paling penting untuk dilakukan. Mengingat, semua sifat-sifat fisik dari suatu larutan.

Contoh Soal Fraksi Mol Sekolahin
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.