Jelaskan tentang konfigurasi elektron beserta cont...
Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya. Harus diingat bahwa masing-masing orbital memiliki batas elektron yang dapat mengisinya. Berikut penjelasannya. Orbital s mampu diisi 2 elektron Orbital p mampu diisi 6 elektron Orbital d mampu diisi 10 elektron Orbital f mampu diisi 14 elektron
Pengertian Konfigurasi Elektron Rumus Kimia
Konfigurasi elektron adalah susunan elektron berdasarkan kulit atau orbital dari suatu atom. Jadi ada dua cara menyatakan konfigurasi elektron nih. Namun konfigurasi elektron berdasarkan orbital atom itu, lebih berguna untuk mempelajari sifat-sifat suatu zat kimia, termasuk mengapa ada zat kimia yang berwarna-warni.

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Konfigurasi elektron berhubungan dengan bagaimana suatu jenis partikel atom dapat berikatan dengan atom lain untuk membentuk suatu senyawa. Oleh karena itu dalam penerapan kimia, materi konfigurasi elektron ini penting dan sangat banyak contoh soal mengenai konfigurasi elektron ini. Konfigurasi Elektron
Konfigurasi Elektron Menurut Larangan Pauli Rumus Kimia
Konfigurasi elektron adalah susunan elektron dalam orbital atom. Konfigurasi elektron bisa kamu identifikasi dengan menentukan kompleksi subshell dan nomor orbitalnya. Orbital elektron terbagi ke dalam beberapa kategori, yaitu: s, p, d, dan f. Semua kategori orbital memiliki arah yang berbeda-beda.

Konfigurasi elektron atom 40 20 Ca adalah
Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya. Lintasan peredaran elektron ini disebut juga kulit elektron atau bilangan kuantum utama (n).

Konfigurasi Elektron Berdasarkan Orbital YouTube
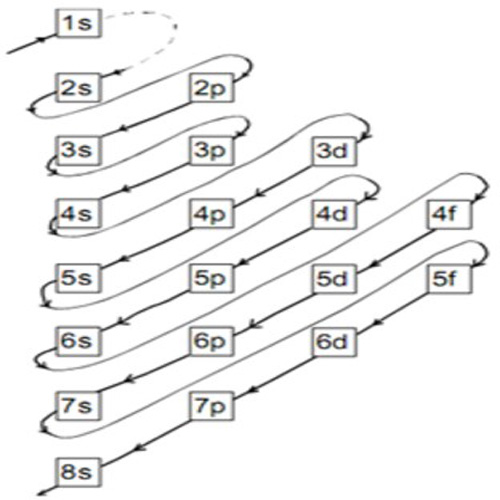
Jadi, konfigurasi elektron untuk kalsium adalah: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2. Catatan: Tingkat energi berubah saat orbit Anda bertambah besar. Contohnya, saat Anda akan mencapai tingkat energi ke-4, maka 4s akan menjadi yang pertama, lalu 3d. Setelah tingkat energi ke-empat, Anda akan menuju tingkat ke-5 di mana urutannya kembali seperti awal.

Konfigurasi elektron atom 80 35 Br adalah....
Secara lebih jelas Konfigurasi elektron dapat diartikan sebagai suatu penataan atau penyusunan elektron ke dalam kulit dan subkulit atom. Berdasarkan pengertian diatas dapat dijelaskan bahwa terdapat dua cara dalam suatu penulisan konfigurasi elektron. Cara tersebut yaitu bisa berdasarkan kulit atom atau berdasarkan subkulit atomnya.

KONFIGURASI ELEKTRON TEORI ATOM BOHR YouTube
Jadi elektron valensi dari nitrogen adalah 5. 2. Silikon: (NE) 3s² ep² Struktur elektron dalam silikon ditulis dengan singkat supaya mudah dalam menentukan elektron valensinya. Jumlah elektron yang terletak di 3s dan 3p merupakan elektron valensi, jadi elektron valensi silikon adalah 2+2 = 4. 3. Vanadium: (Ar) 3d³ 4s²
Konfigurasi elektron ion L^(3+) adalah 1s^2 2s^2 2p^6 3s^...
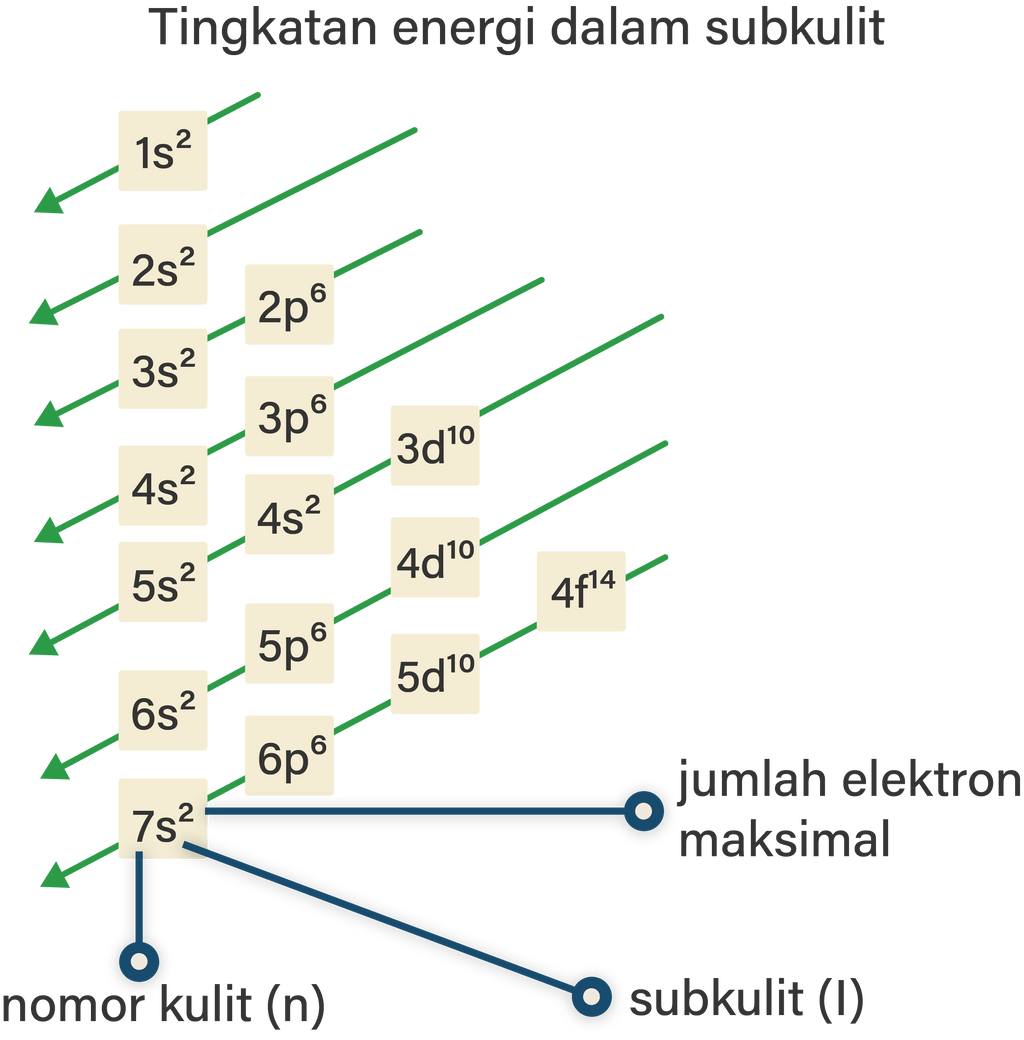
Jumlah elektron maksimal yang menempati subkulit atom adalah 2 untuk subkulit s, 6 untuk subkulit p, 10 untuk subkulit d, dan 14 untuk subkulit f. Sehingga lebih lengkapnya, konfigurasi elektron mengikuti urutan berikut. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6. Contoh: 16 S : 1s 2 2s.

Konfigurasi elektron atom Fe adalah 1s^2 2s^2 2p^6 3s^2 3...
Diketahui bahwa penemu dari elektron adalah JJ Thomson melalui percobaan sinar katode, sedangkan untuk muatan elektron sendiri ditemukan oleh Robert Millikan, melalui percobaan tetesan halus minyak.. Konfigurasi elektron merupakan penyusunan atau lapisan elektron berdasarkan tingkat energinya dalam suatu atom, di mana atom memiliki lapisan.

Cara Menentukan Konfigurasi Elektron
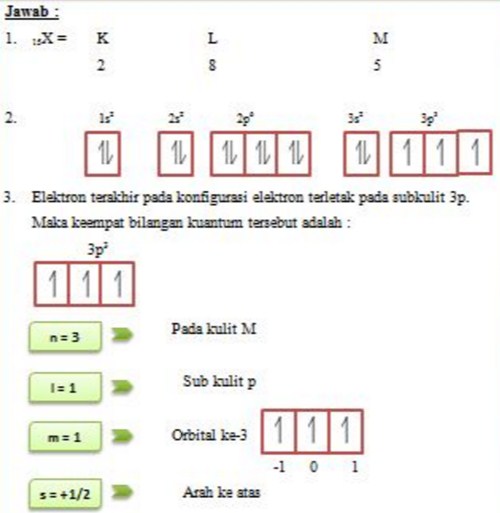
Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah hund, larangan pauli, serta hukum mekanika kuantum.

Konfigurasi Elektron
Konfigurasi elektron merupakan konsep yang berperan penting dalam kimia terutama mengenai interaksi antar atom. Untuk memahaminya, terdapat istilah-istilah yang perlu kita tahu yang akan dijabarkan berikut ini. Daftar Isi A. Istilah dalam Konfigurasi Elektron 1. Kulit Elektron, Subkulit, dan Orbital a. Kulit Elektron b. Subkulit c. Orbital 2.

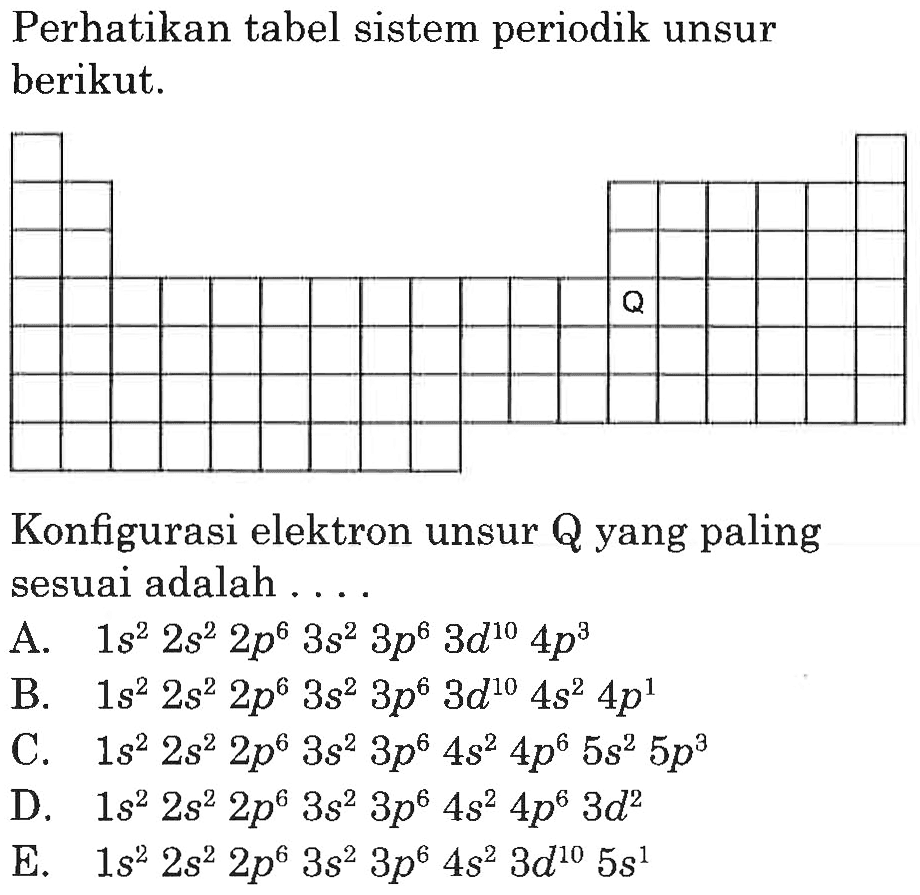
Konfigurasi elektron suatu unsur X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5. Unsur
Konfigurasi elektron adalah susunan penyebaran (pengisian) elektron-elektron dalam. Seperti yang telah dibahas dalam bab Struktur Atom, di dalam atom terdapat partikel subatomik neutron dan proton yang terdapat pada inti atom, dan elektron yang bergerak mengelilingi inti atom tersebut pada kulit-kulit elektron (level-level energi) yang tertentu.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Konfigurasi elektron merupakan susunan elektron di dalam atom yang mengikuti aturan tertentu. Pada artikel ini, Quipper Blog akan mengajak Quipperian untuk belajar tentang konfigurasi elektron beserta jenis dan aturan penulisannya. Yuk, simak selengkapnya! Daftar Isi Sembunyikan Pengertian Konfigurasi Elektron Jenis-Jenis Konfigurasi Elektron

Diketahui konfigurasi elektron ion Cu^(2+) adalah 1 s^...
Dalam fisika atom dan kimia kuantum, konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur fisik lainnya. [1] Sama seperti partikel elementer lainnya, elektron patuh pada hukum mekanika kuantum dan menampilkan sifat-sifat bak-partikel maupun bak-gelombang.
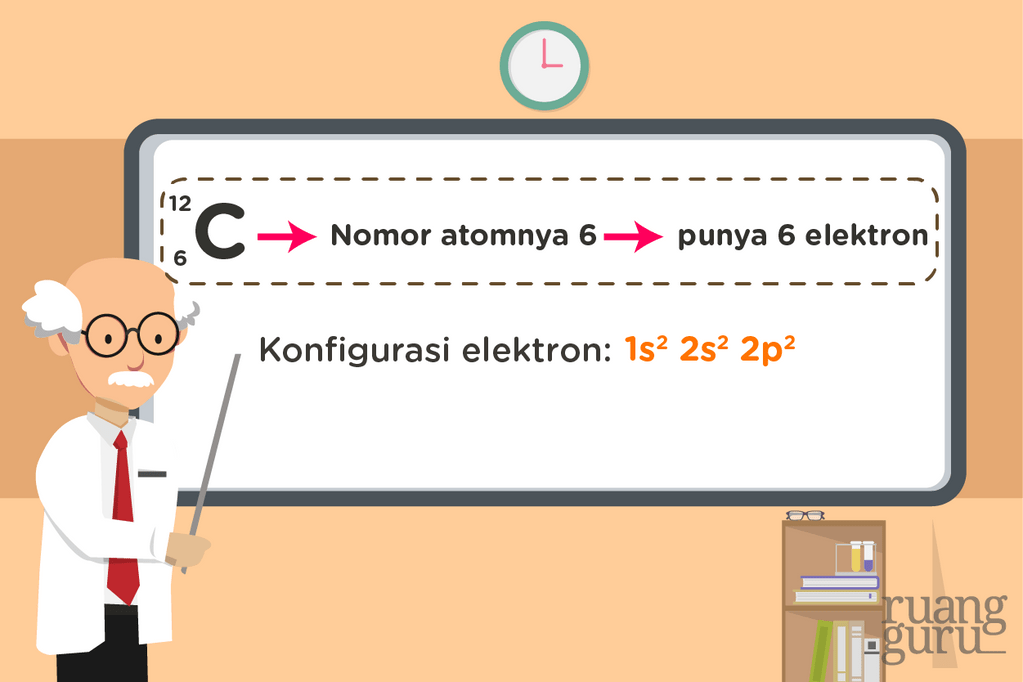
Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
Pengertian konfigurasi elektron adalah pengambarkan susunan elektron dalam orbital- orbital atom. Dengan mengetahui hal ini, jumlah elektron pada kulit terluar dapat ditentukan. Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1.