
Contoh Soal Titik Didih Homecare24
Kenaikan titik didih. Kenaikan titik didih menggambarkan fenomena bahwa titik didih dari cairan (suatu pelarut) akan lebih tinggi ketika senyawa lain ditambahkan, yang berarti bahwa larutan akan memiliki titik didih yang lebih tinggi daripada pelarut murninya. Hal ini terjadi ketika zat terlarut yang tidak mudah menguap, seperti garam.

Pengertian dan Rumus Kenaikan titik didih larutan
Artinya, dalam larutan sukrosa berupa molekul dan bukan berupa ion. Untuk menghitung kenaikan titik didih larutan sukrosa, dapat digunakan rumus sebagai berikut: ΔTb = kb x m ΔTb = 0,51°C/m x 5 m ΔTb = 2,55°C Jadi, kenaikan titik didih larutan sukrosa adal ah 2,55°C. Baca pembahasan lengkapnya dengan daftar atau masuk akun Ruangguru.
Contoh Soal Sifat Koligatif Larutan Materi Kimia
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.

Unduh Perbandingan Tetapan Penurunan Titik Beku dengan Titik Didih Molal Air Tonton daring
Kenaikan titik didih adalah kenaikan titik didih suatu pelarut tertentu setelah ditambahkan zat terlarut yang tidak mudah menguap. Titik didih pelarut murni adalah . Maka nilai titik didih larutan tersebut dapat dihitung sebagai berikut: Dengan demikian maka titik didih larutan tersebut adalah . Oleh karena itu, jawaban yang benar adalah B.

kenaikan titik didih(penjelasan di deskripsi) YouTube
Untuk menghitung kenaikan titik didih larutan 5 molal sukrosa, dapat menggunakan rumus sebagai berikut: Kenaikan Titik Didih (ΔT) =. Konsentrasi Larutan (m) x. Kenaikan Titik Didih Molal (Kf) Dalam hal ini, konsentrasi larutan = 5 molal dan kenaikan titik didih molal sukrosa = 0,512℃/molal. Oleh karena itu:

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
"Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Kenaikan titik didih la.

Kenaikan titik didih larutan 5 molal sukrosa adalah (Kb. air .=0,51 C) A. 2,51 C B. 3,53 C
Berikut adalah contoh soal materi sifat koligatif larutan kelas 12 semester 1 serta jawabannya. 1. Semua sifat berikut tergolong sifat koligatif larutan, kecuali.. A. Penurunan Tekanan Uap. B. Kenaikan Titik Didih. C. Penurunan Titik Beku. D. Tekanan Osmosis. E. Kepekatan Larutan.

Kenaikan Titik Didih Larutan 5 Molal Sukrosa Adalah kekurangan dalam teks ulasan
Contoh Soal 1 Kenaikan Titik Didih. Tentukan kenaikan titik didih larutan gula 0,2 molal jika K b air = 0,52 °C molal-1. Pembahasan. Larutan gula 0,2 molal : ΔT b = K b. m = 0,52 °C molal-1 x 0,2 molal = 0,104 °C Jadi, kenaikan titik didih larutan gula tersebut adalah 0,104°C. Contoh Soal 2 Kenaikan Titik Didih

Kenaikan Titik Didih Larutan YouTube
Dalam 100 gram larutan glukosa 12% terdapat: m 1.000 46 1.000 m= Mr × = 46 × 54 = 18,52 molal p 12 glukosa 12% = 100 × 100 g = 12 gram Jadi, molalitas larutan C2H5OH sebesar 18,52 m. air (pelarut) = 100 - 12 = 88 gram 12 g B. Uraian Jumlah mol glukosa = = 0,067 mol 180 g mol−1 1.

Tetapan kenaikan titik didih molal (Kb) tergantung pada.
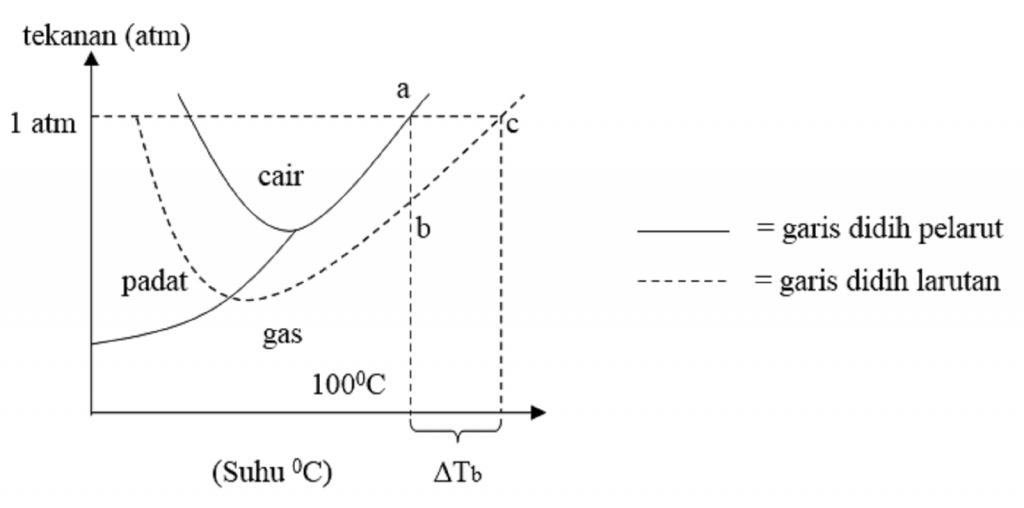
Kenaikan Titik Didih dan Penurunan Titik Beku Untuk memahami konsep kenaikan titik didih larutan kita akan contoh dalam kehidupan sehari-hari yakni apabila ke dalam air dilarutkan suatu zat tertentu, seperti yang kita ketahui akan terjadi penurunan tekanan uap larutan, sehingga pada suhu $\mbox{100}^{\circ}\mbox{C}$ larutan air belum mendidih.

PRAKTIKUM I PENURUNAN TITIK BEKU LARUTAN I. · PDF fileMempelajari kenaikan titik didih beberapa
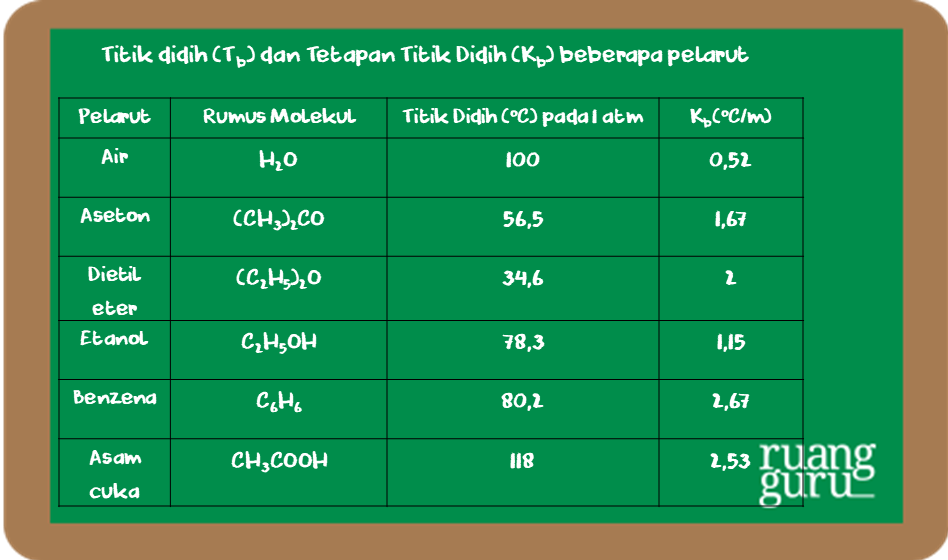
Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb. Dengan, ∆ Tb =kenaikan titik didih (boiling point elevation) m = molalitas. Kb = tetapan kenaikan titik didih (oC kg/mol) Titik didih melibatkan lebih dari satu fase kondisi atau fase zat terkait (fase cair-gas).
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Haiko fans pada soal ini ditanyakan kenaikan titik didih atau Delta TB larutan 5 mol sukrosa adalah di sini diketahui 0,51 derajat Celcius sukrosa merupakan zat nonelektrolit yang sama dengan 0 dengan 1 ditambah jumlah dikurang 1 dikali Alfa akan = 1 karena apanya = 0 Delta TB = molalitas dikalikan dengan molalitasnya di sini adalah 5 molal dan KB nya adalah 0,51 serta ini adalah 1 maka Delta.

SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH YouTube
Pembahasan. Titik didih adalah suhu dimana tekanan uap suatu cairan sama dengan tekanan udara luar. Penurunan tekanan uap larutan menyebabkan titik didih larutan lebih tinggi dari titik didih pelarut murni. Kenaikan titik didih larutan sukrosa adalah sebagai berikut. Jadi, kenaikan titik didihnya adalah 2,55 .

PPT SIFAT KOLIGATIF LARUTAN PowerPoint Presentation, free download ID4367330
Tb = 100°C + ΔTb. = 100°C + 0,0416°C = 100,0416°C. Jadi, Tidik didih larutan tersebut yaitu 100,0416°C. Itulah ulasan mengenai √ Titik Didih : Pengertian, Kenaikan, Faktor, Rumus & Contoh Soalnya Lengkap. Semoga apa yang telah diulas dapat bermanfaat bagi pembaca. Sekian dan terima kasih.

Rumus Dan Contoh Soal Kenaikan Titik Didih Larutan Elektrolit Dan Non Riset
Kenaikan titik didih juga demikian. Pada larutan encer, kenaikan titik didi larutan (ΔTb) sama dengan molalitas (m) larutan yang mengandung pertikel zat terlarut (nonvolatil) dikalikan dengan tetapan kenaikan titik didih molal (K b). Kenaikan titik didih ini dirumuskan: ΔT b = T b - T b o = m K b. Keterangan ΔT b = kenaikan titik didih larutan

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Tb = 100 + 0,6656 = 100,6656 °C. Contoh soal 6 (UN 2019) Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut. Contoh soal 6. Jika Mr NaCl = 58,5 dan Mr glukosa = 180 dan Tb air = 100 C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah…. A. 0,52 °C/m.