
Sifat Keperiodikan Unsur ( Part 2) Afinitas Elektron, Keelektronegatifan dan Sifat Logam
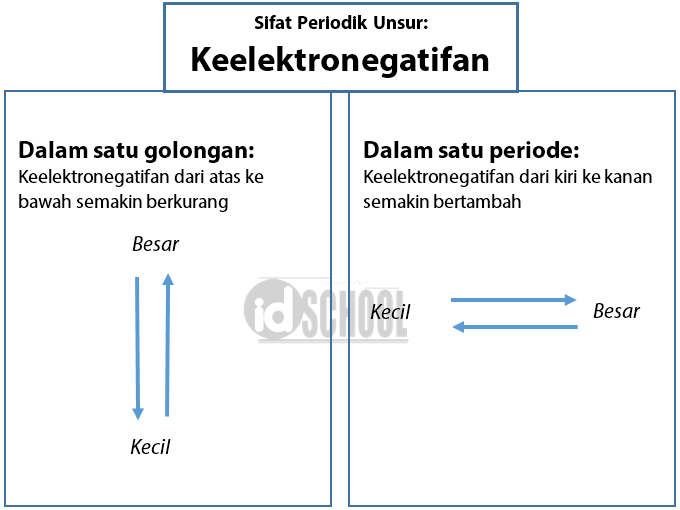
Dalam satu golongan, dari atas ke bawah maka keelektronegatifannya cenderung semakin berkurang. Dalam suatu periode, dari kiri ke kanan maka keelektronegatifannya cenderung semakin bertambah. Ilustrasi logam (Dok PxHere.com) Sifat kelogaman suatu unsur tergantung pada besarnya energi ionisasi, dan afinitas elektron.

latihan soal UN keelektronegatifan dalam Satu golongan kimia SMA YouTube
Dalam satu golongan Elektronegatifitas memiliki kecenderungan dari atas ke bawah semakin KECIL sedangkan dalam satu periode dari kiri ke kanan semakin BESAR. Pada soal, terdapat 5 unsur yaitu , , , , dan .: golongan VA periode 3: golongan IIIA periode 3: golongan VIIA periode 4: golongan IA periode 3: golongan VIIA periode 3

Data keelektronegatifan beberapa unsur H=2,1;F=4,0;Cl=3...
Keelektronegatifan. Keelektronegatifan adalah kecenderungan suatu atom untuk menarik elektron. Dalam satu periode, semakin ke kanan keelektronegatifannya semakin besar. Dalam satu golongan, semakin ke bawah keelektronegatifannya semakin kecil. Nah, untuk mengasah pemahamanmu tentang sistem periodik unsur, yuk simak contoh soal berikut ini.

Tabel periodik unsur terdiri dari unsurunsur kimia yang telah ditemukan atau dibuat; mereka
Jadi, keelektronegatifan bertambah apabila kita maju dari bawah ke atas dalam golongan tertentu dari susunan berkala,karena elektron valensi lebih dekat ke inti. Untuk mengamati keelektronegatifan suatu unsur, kalian dapat melihat skala pauling yang dapat menunjukkan tingkat keelektronegatifan suatu unsur.

Keelektronegatifan unsur golongan VIA dalam skala Pauling...
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen. Konsep elektronegativitas pertama kali oleh Linus Pauling pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi.

Trik Super Kilat Memahami Keelektronegatifan
Sama halnya dengan jari-jari atom, sifat keperiodikan unsur yang satu ini juga memiliki kecenderungan sebagai berikut: Dalam satu golongan dari atas ke bawah, energi ionisasi suatu unsur semakin kecil dikarenakan jari-jari atom bertambah besar, sehingga daya tarik inti terhadap elektron terluar semakin lemah dan energi ionisasi berkurang.

Data harga keelektronegatifan unsurunsur dalam satu peri...
Keelektronegatifan Pauling, tanpa diragukan lagi, adalah skala yang paling luas dan digunakan, terutama dalam kursus kimia dasar atau kimia umum. Pada skala ini, nilai sewenang-wenang 4,0 ditetapkan untuk keelektronegatifan unsur paling elektronegatif dalam tabel periodik, fluor, dan nilai lainnya ditetapkan berdasarkan nilai referensi tersebut.
Unsur 8a Terletak Dalam Satu Golongan Dengan Unsur D Berbagai Unsur
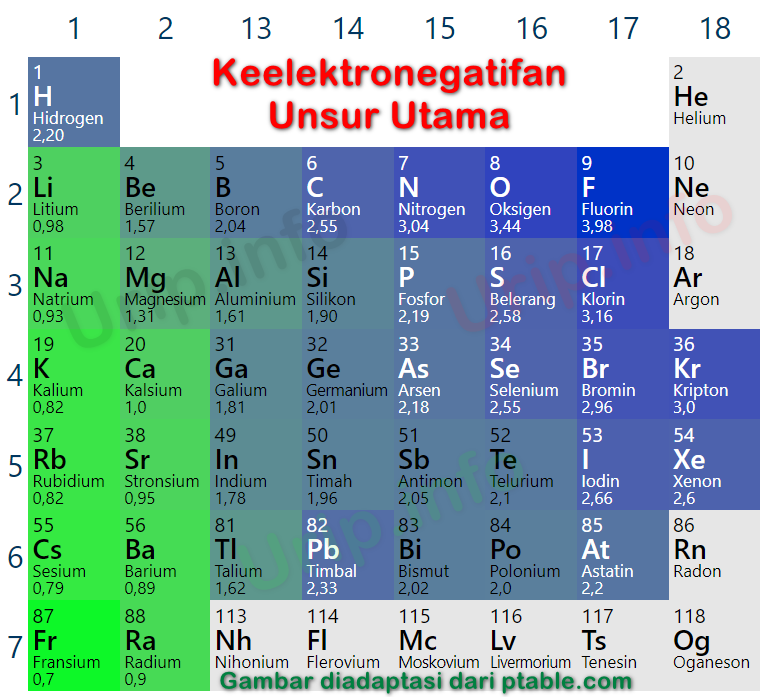
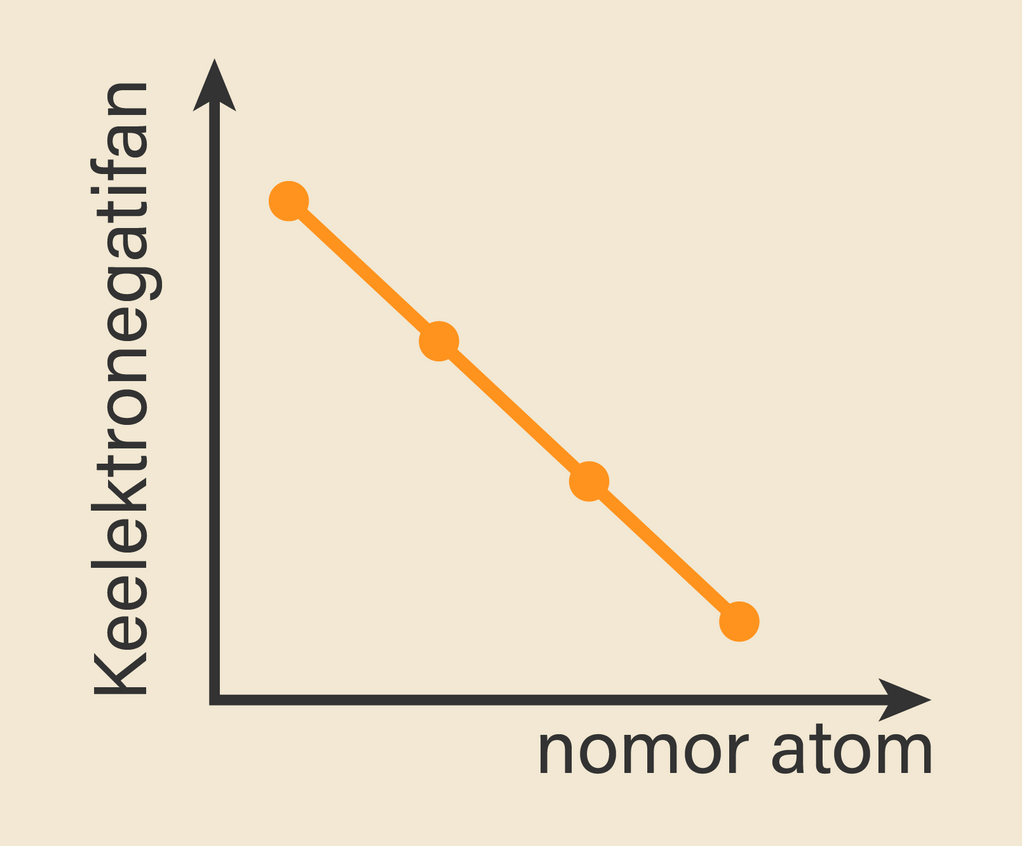
Adapun Unsur fransium yang memiliki keelektronegatifan terendah yaitu 0,7 berada di kiri paling bawah dalam tabel periodik. Kesimpulannya : Dalam satu periode dengan bertambahnya nomor atom, keelektronegatifan cenderung makin besar, dan dalam satu golongan dengan bertambahnya nomor atom, keelektronegatifan cenderung makin kecil.
Sistem Periodik Unsur Sifatsifat pada Tabel Periodik Unsur Kimia
Dilansir dari Chemistry LibreTexts, keelektronegatifan menurun ke bawah satu golongan karena pasangan elektron ikatan makin jauh dari gaya tarik inti. Seperti yang kita ketahui, atom dari atas ke bawah dalam suatu golongan memiliki jumlah elektron yang lebih banyak. Hal tersebut menyebabkan jari-jari atom tersebut lebih besar.
Sifat Periodik Unsur
7). Golongan VIIA : F(4,0), Cl(3,0), Br(2,8), I(2,5), At(2,1). Pada ilustrasi di atas ditunjukkan bagaimana kecenderungan sifat keelektronegatifan unsur-unsur golongan utama (IA - VIIA). Golongan VIIIA tidak dimasukkan dalam daftar karena golongan gas mulia umumnya berupa gas yang sangat stabil sehingga tidak reaktif.

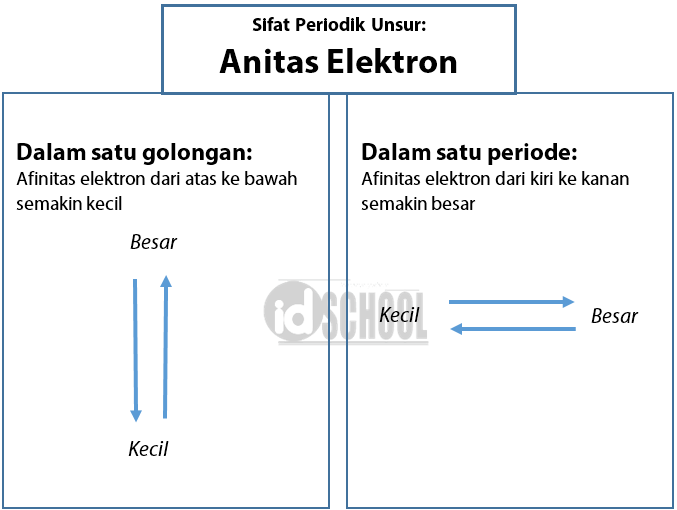
Bagaimana Kecenderungan Afinitas Elektron Unsur Dalam Sistem Periodik sisi tegak pada bangun
Keelektronegatifan merupakan kecenderungan atau ukuran kemampuan suatu unsur untuk menarik elektron dan dalam membentuk ikatan ikatan. Dalam satu golongan dari atas ke bawah, keelektronegatifan semakin kecil karena jari-jari semakin panjang sehingga daya tarik inti terhadap elektron semakin lemah.

Tabel Periodik Unsur Kimia Lengkap
Keelektronegatifan adalah sifat atom yang meningkat dengan kecenderungannya untuk menarik elektron ikatan. Jika dua atom terikat mempunyai nilai keelektronegatifan yang sama antara satu sama lain, mereka berkongsi elektron secara sama rata dalam ikatan kovalen. Biasanya, elektron dalam ikatan kimia lebih tertarik kepada satu atom (yang lebih.
Mengapa Cl Mempunyai Bermacammacam Bilangan Oksidasi? Urip dot Info
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika atomatom tersebut membentuk ikatan. Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 sampai 4. Yang mana, unsur yang mempunyai harga keelektronegatifan besar, cenderung menerima elektron dan akan membentuk ion negatif.
Berikut tabel data unsur dan nomor atomnya.
Pengertian Sifat Keperiodikan Unsur. Sifat Keperiodikan Unsur adalah sifat-sifat unsur yang berubah secara beraturan sesuai dengan kenaikan nomor atom unsur dari atas ke bawah pada suatu golongan atau dari kiri ke kanan dalam satu periode. Nah Sifat Keperiodikan Unsur ini meliputi pengaruhnya terhadap Jari-Jari Atom, Energi Ionisasi, Afinitas.

PPT Perkembangan Model Atom PowerPoint Presentation, free download ID398871
keelektronegatifan dalam satu golongan Unsur golongan satu dan dua memiliki keelektronegatifan yang lebih kecil; dengan demikian, mereka.

Keelektronegatifan unsur dalam satu periodekimia sma YouTube
Dalam satu periode keelektronegatifan bertambah dari kiri ke kanan, sedangkan dalam satu golongan keelektronegatifan bertambah dari bawah ke atas. Post Views: 828. Tags: afinitas elektron energi ionisasi jari-jari atom keelektronegatifan Kimia Kelas X sifat keperiodikan unsur. Share 13 Send.