
LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Contoh dari basa kuat seperti natrium hidroksida (NaOH), litium hidroksida (LiOH), kalium hidroksida (KOH), barium hidroksida (Ba(OH)2), dan kalsium hidroksida (Ca(OH)2). 2. Asam lemah dan basa lemah. Asam lemah adalah asam yang hanya terionisasi sebagian di dalam air sehingga nilai a-nya kecil.

Teori Asam Basa
Kalium hidroksida adalah suatu senyawa anorganik dengan rumus kimia K OH, dan umumnya disebut sebagai potash kaustik.. Bersama dengan natrium hidroksida (NaOH), padatan tak berwarna ini adalah suatu basa kuat.Senyawa ini memiliki banyak aplikasi industri dan niche, sebagian besar yang memanfaatkan sifat korosif dan reaktivitasnya terhadap asam.Diperkirakan 700,000 hingga 800,000 ton telah.

Uji Asam Basa Menggunakan Indikator Alami Praktikum Kimia Kelas 11 MIPA YouTube
Kalium hidroksida (KOH) Baca juga: Ciri-ciri Larutan Basa. Asam lemah dan basa lemah.. di antara senyawa oksida ada juga yang dikenal dengan oksida indiferen yang tidak bisa menghasilkan asam atau basa. Contohnya seperti NO maupun CO. Lalu ada juga oksida amfoter yang bisa bereaksi dengan ion asam (H+) dan ion basa (OH-), mislanya ZnO atau.

LENGKAP ‼️ REAKSI ASAM BASA KELAS 11 ‼️ REAKSI PENGGARAMAN YouTube
Larutan Asam. Sangat mudah menemukan senyawa asam dalam beragam barang sehari-hari, termasuk pada makanan, minuman, atau cairan pembersih rumah. Jeruk, lemon, dan tomat merupakan contoh buah dan sayur yang mengandung asam. Cuka dapur sebagai penambah rasa juga mengandung asam asetat. Aki pada kendaraan bermotor terdiri dari asam sulfat.

Persamaan reaksi dari kalsium hidroksida + asam klorida menghasilkan kalsium klorida dan air
Ini adalah struktur kimia kalium hidroksida. Todd Helmenstine. Kalium hidroksida: KOH Kalium hidroksida adalah basa kuat. Hal ini juga dikenal sebagai alkali, natrium hidrat, kalium kaustik dan alkali kalium. Kalium hidroksida adalah padatan putih atau tidak berwarna, digunakan secara luas di laboratorium dan proses sehari-hari.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Kalium hidroksida (KOH) adalah basa kuat, yang digunakan dalam industri untuk menetralisir asam kuat dan lemah, untuk mengendalikan pH dan untuk pembuatan garam kalium. Basa ini juga digunakan untuk menyabunkan lemak dan minyak, dalam pembersih industri, dan dalam reaksi hidrolisis, misalnya untuk ester. Kalium nitrat (KNO) atau saltpeter.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Proses titrasi asam basa melibatkan larutan asam kuat atau basa kuat yang bisa berbahaya bagi tubuh, jadi harus dilakukan di dalam laboratorium dengan didampingi oleh guru atau asisten laboratorium. Sebelum melakukan eksperimen ini pun, kamu harus mengenakan alat pelindung diri seperti baju atau jas lab, sarung tangan, dan kacamata ( goggles.

Pengertian Asam dan Basa Serta Penggunaannya
Basa juga bisa menetralisir asam (H+) sehingga membentuk H2O (air). Contoh benda yang bersifat basa dalam kehidupan sehari-hari adalah sabun. Misalnya reaksi kimia Kalium hidroksida (KOH) + air (H2O) berikut ini: KOH + air → K+ + OH-- Beberapa sifat dari senyawa basa: 1.

Reaksi antara larutan kalium hidroksida dengan larutan as...
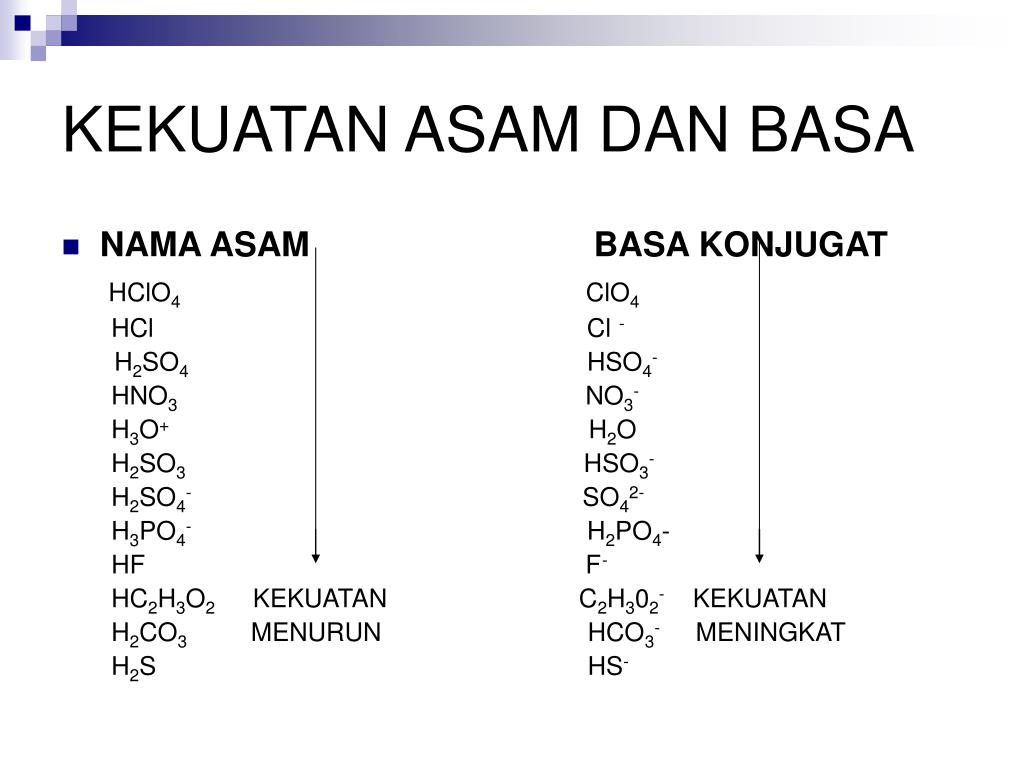
Sementara basa kuat adalah senyawa basa yang jika dilarutkan dalam air mudah melepaskan ion OH-, larutan basa ini juga akan mengalami disosiasi total. Contoh basa kuat misalnya kalium hidroksida (KOH), natrium hidroksida atau sodium hidroksida (NaOH), dan barium hidroksida (Ba(OH)2). 2. Asam Lemah dan Basa Lemah
Teori Asam Basa dan Garam Siswapedia
Raksa ( bahasa Inggris : mercury) adalah sebuah unsur kimia dengan lambang Hg dan nomor atom 80. Ia juga dikenal sebagai air raksa dan dulunya bernama hydrargyrum ( haɪˈdrɑːrdʒərəmHY-drar-JƏR-əm) dari kata Yunani hydro (air) dan argyros (perak). [5] Merupakan sebuah unsur blok-d yang berat dan keperakan, raksa adalah satu-satunya unsur.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
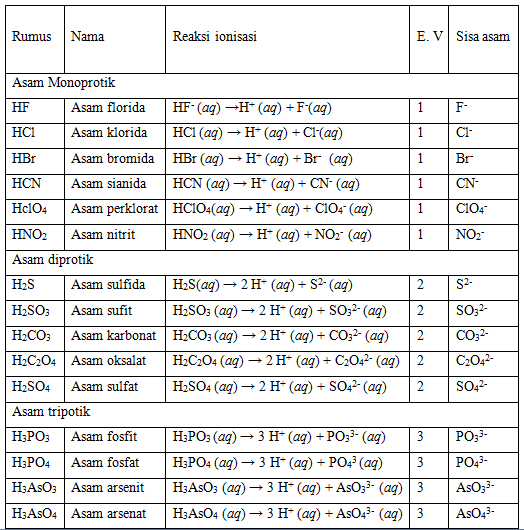
NaOH (natrium hidroksida) Hl (asam iodida) KOH (kalium hidroksida) HBr (asma bromida) Ba(OH) 2 (barium hidroksida) HNO 3 (asam nitrat) Ca(OH) 2 (kalsium hidroksida). Dalam mengenali sifat asam atau basa suatu larutan, kita dapat menggunakan indikator asam basa, yaitu bahan kimia yang dapat menunjukkan warna berbeda dalam larutan asam dan basa.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Misalnya reaksi asam sulfat (H2SO4) dan kalium hidroksida (KOH) yang menghasilkan air dan senyawa ionic garam kalium sulfat (K2SO4).. (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima.

7. Tentukan persamaan kimia berikut magnesium hidroksida + asam asetat Mylanta
Sementara basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air serta senyawa ionic garam. Reaksi itu disebut reaksi netralisasi. Asam dan basa merupakan dua jenis larutan yang kerap digunakan dalam kehidupan sehari-hari manusia. Asam dan basa ada yang memiliki sifat kuat dan juga lemah.
CINTA KIMIA PH REAKSI ASAM DAN BASA
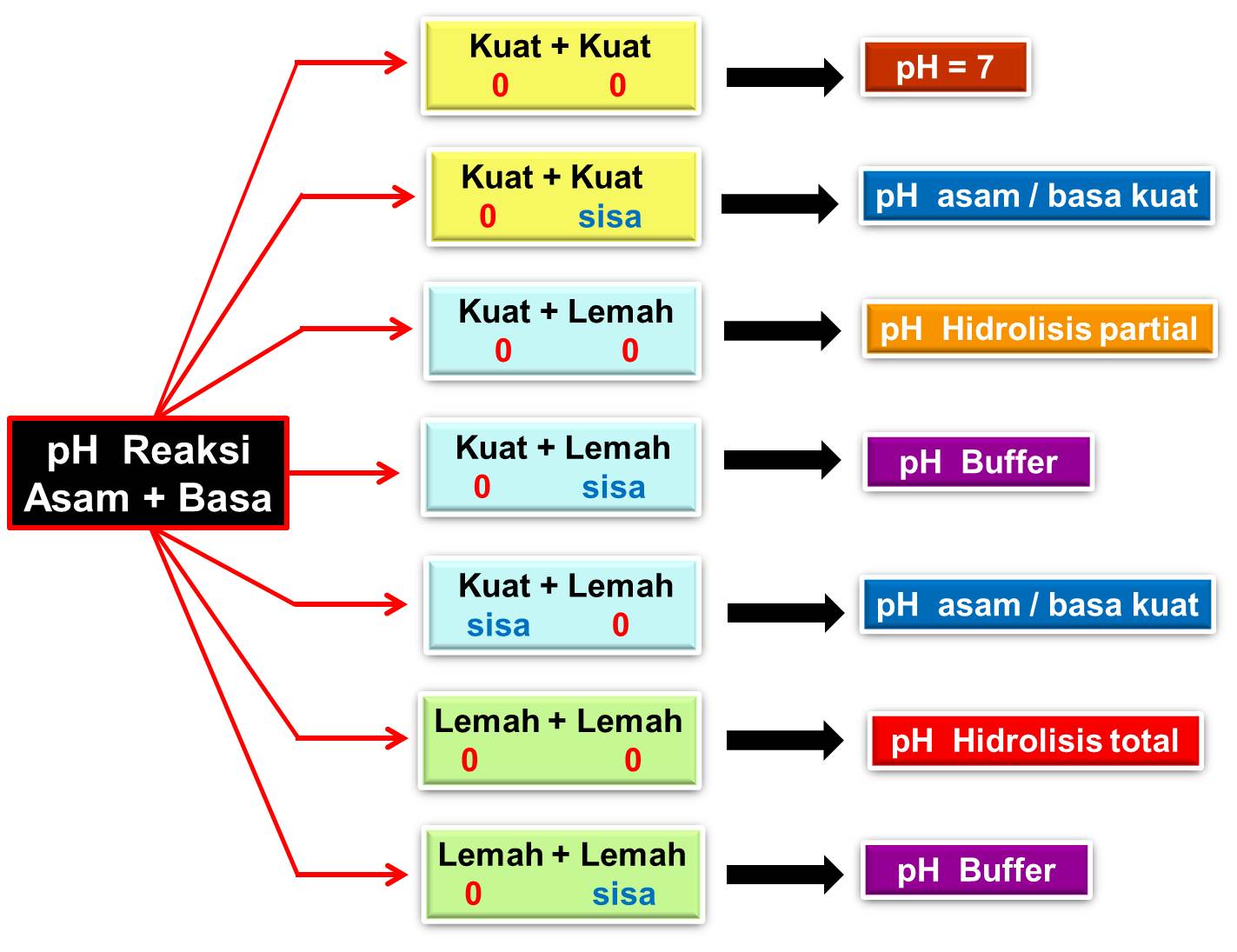
Asam + basa → garam + air. HCl + KOH → KCl + H2O. Garam dapur (NaCl) diperoleh dari air laut yang mengalami penguapan dan kristalisasi. Untuk menjadikannya garam beryodium, harus diproses iodisasi (garam kalium/KI). Sifat-sifat atau ciri-ciri garam: Larut dalam air. Contohnya : KNO3, NH4Cl, Na2SO4. Sukar larut dalam air.
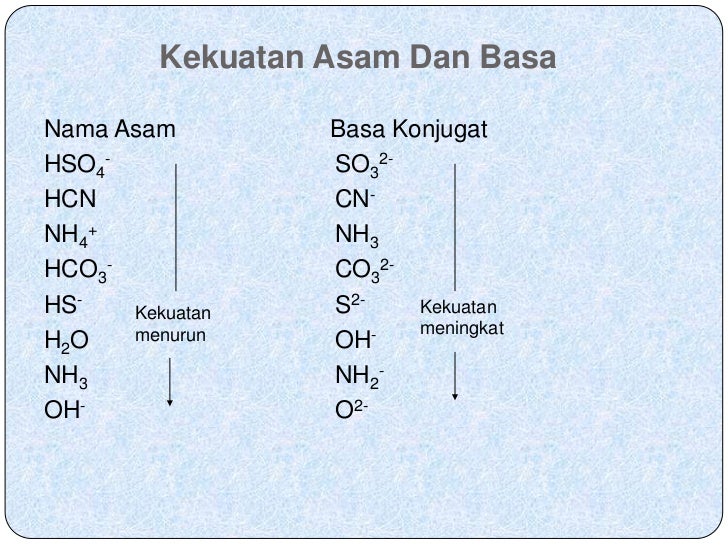
Asam basa
Contohnya, ketika natrium hidroksida direaksikan dengan kalium hidroksida (KOH), maka akan terbentuk garam natrium kalium (NaK) dan air (H2O).. Ketika natrium hidroksida bereaksi dengan asam atau basa, maka akan terjadi reaksi netralisasi yang menghasilkan garam dan air. Namun, penggunaan natrium hidroksida harus dilakukan dengan hati-hati.

Tuliskan rumus kimia asam/basa berikut. a. Asam klorida b...
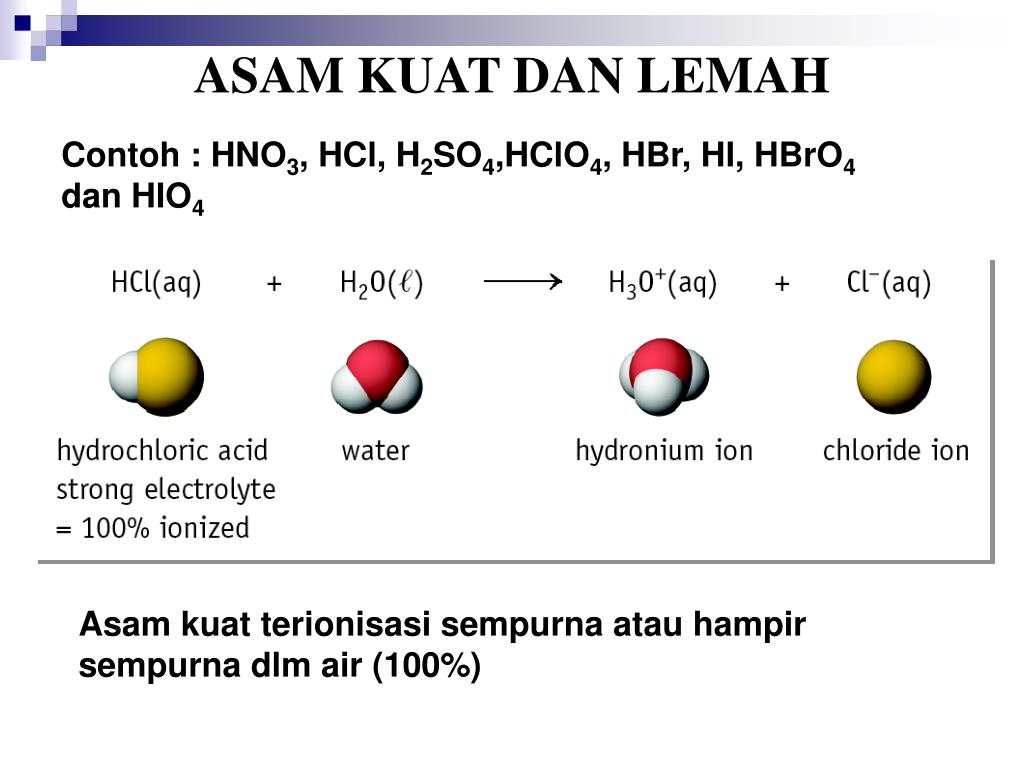
Contoh basa kuat antara lain natrium hidroksida (NaOH) dan kalium hidroksida (KOH). Perlu dicatat juga bahwa kekuatan suatu asam atau basa tidak terkait dengan konsentrasinya dalam larutan. Akan tetapi, kekuatan larutan asam dan basa mengacu pada sejauh mana molekul asam atau basa mengionisasi dalam larutan.