PPT Perlakuan Dasar Logam PowerPoint Presentation, free download ID3928358
Jika pada katoda diendapkan logam krom sebesar 10,4 gram dan 1 F = 96500C, maka waktu yang diperlukan untuk proses elektrolisis tersebut adalah.. (Ar Cr = 52) 57900 detik

Jelaskan Prinsip Penggunaan Sebuah Bahan Ditaruh Di Suatu Elektroda (Anoda Atau Katoda
Jika logam perak diendapkan sebanyak 21,6 gram, berapa gram logam tembaga yang diendapkan? (ArAg=108, .Cu=63, 5) Massa logam tembaga yang diendapkan pada rangkaian arus listrik larutan AgNO3 dan larutan CuSO4 dengan logam perak yang diendapkan 21,6 gram adalah 6,35 gram. Jika Di Katoda Diperoleh Tembaga Sebesar 6 35 Gram

Tuliskan reaksi yang terjadi di anoda dan katoda dari elektrolisis lelehan NaCl YouTube
Massa logam Mg yang diendapkan di katoda jika larutan MgSO 4 dielektrolisis menggunakan arus 4A selama 2.895 detik adalah. Bila logam tembaga diendapkan sebanyak 17,5 gram, maka logam perak yang diendapkan adalah sebanyak…(Ar Ag = 108 dan Ar Cu = 63,5). jika ingin mengendapkan semua tembaga menggunakan arus sebesar 10 A maka waktu yang.

Anoda dan Katoda Ilmu Kimia
Jika di katoda diperoleh tembaga sebesar 6,35 gram, maka volume gas yang dihasilkan di anoda (stp) adalah..(massa molar cu = 63,5 g/mol). Jika di katoda diperoleh tembaga sebesar 6,35 gram, maka volume gas yang dihasilkan di anoda (stp) adalah..(massa molar cu = 63,5 g/mol) 15. 1. Jawaban terverifikasi. Iklan. Iklan. YY. Y. Yeni.
+%2B+n+é+X+(reduksi)+Anoda++Y(s)+Ym+%2B+%2B+m+é+(oksidasi)+atau++Zm+-(aq)+Z+%2B+m+é+(oksidasi)+(Instagram+Post)+(Presentation+(169)).png/c8fff1f8-30e6-7ba6-a46c-a453977effe7?imagePreview=1)
Reaksi Yang Terjadi Pada Katode Dari Elektrolisis Larutan Na2so4 Adalah
Pada sel elektrolisis di anode terjadi reaksi oksidasi. Jika menggunakan elektrode selain Pt, Au dan C maka elektroda itu sendiri bereaksi dianode. Sehingga di anode terjadi reaksi : Cu(s) → Cu 2+ (aq) + 2e. 30. Pada elektrolisis cairan MgCl 2, pada katode dan anode berturut dibebaskan. a. H 2 dan Cl 2. b. H 2 dan O 2. c. Mg dan Cl 2. d.
Perhatikan proses elektrolisis logam tembaga mengg...
13. Logam Natrium dapat diperoleh dengan cara mengelektrolisis lelehan NaCl menggunakan elektroda inert, massa logam Natrium yang dihasilkan di katoda dari elektrolisis lelehan NaCl selama 20 menit dengan kuat arus 5 A adalah sebesar.. (Ar Na = 23 gr/mol; Cl = 35,5 gr/mol) 1,43 gr; 2,35 gr; 3,75 gr; 5,23 gr; 6,44 gr . Jawaban: A. Pembahasan.

Jika Di Katoda Diperoleh Tembaga Sebesar 6 35 Gram
Pada elektrolisis larutan MSO 4 di katoda diendapkan 0,28 gram logam M, jika larutan hasil elektrolisis dapat dinetralkan oleh 50 mL larutan NaOH 0,2 M,. dihasilkan endapan Cu sebanyak 6,35 gram, jika arus yang digunakan adalah 2 ampere,. Jika larutan tembaga (II) sulfat dielektrolisis dengan elektroda tembaga, pada katoda akan terbentuk

Sendok logam yang terbuat dari seng akan disepuh dengan l...
Soal #6 Dalam elektrolisis larutan LSO 4 dengan elektrode inert, dihasilkan 448 mL gas di anode (STP), dan 2,56 gram endapan logam L di katoda Ar L adalah. Pembahasan Soal #6: Elektrolisis larutan LSO 4: Katode : 2L 2+ + 4e 2L Anode : 2H 2 O 4H + + O 2 + 4e 2L 2+ + 2H 2 O 2L + 4H + + O 2 Karena gas O 2 yang dihasilkan diukur pada keadaan STP maka jumlah mol gas O 2 yang dihasilkan = 0,448.

Tabel Berat Jenis Logam
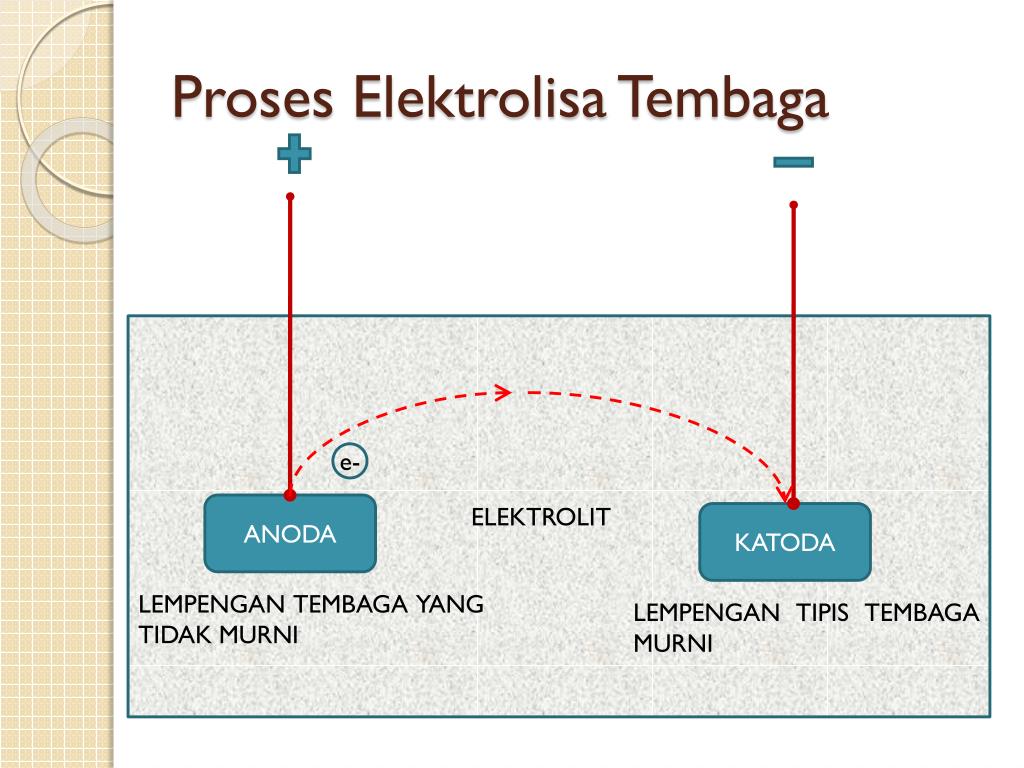
Reaksi elektrolisis larutan encer dengan elektrode grafit. Hasil elektrolisisnya adalah gas oksigen di anode dan gas hidrogen di katode. 2. Reaksi elektrolisis larutan dengan elektrode tembaga. Oleh karena anodenya dari Cu (anode reaktif), maka anode tersebut mengalami oksidasi dan hasilnya adalah ion di anode dan gas hidrogen di katode. Nah.

Jika tembaga(II) sulfat hidrat dipanaskan, terbentuk temb...
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya. Kamu dapat download modul & contoh soal serta kumpulan latihan soal Elektrolisis dalam bentuk pdf pada link dibawah ini: Modul Elektrolisis. Kumpulan Soal Mudah, Sedang & Sukar.

Contoh Soal & Pembahasan Elektrolisis & Hukum Faraday Bagian II My Brain
Perhatikan elektrolisis larutan Cu(NO3)2 di bawah ini Jika di katoda diperoleh tembaga sebesar 6,35 gram maka volume gas yang dihasilkan di anoda (STP) adalah. (Ar Cu = 63,5). (NO3)2 di bawah ini Jika di katoda diperoleh tembaga sebesar 6,35 gram maka volume gas yang dihasilkan di anoda (STP) adalah. (Ar Cu = 63,5) 0. 1. Jawaban.

Cara Cepat Menentukan Reaksi yang Terjadi Di Katoda (UN Kimia 2018 No. 21) YouTube
15. Untuk mengendapkan sebanyak 13 gram Cr ( Ar Cr = 52) dari larutan CrCl 3 dengan arus sebesar 3 A ( 1 F = 96500 C) diperlukan waktu A. 67,0 jam B. 33,5 jam C. 26,8 jam D. 13,4 jam E. 6,7 jam 16. Pada elektolisis larutan CuSO4 dihasilkan logam tembaga (Ar Cu = 63,5) sebanyak 12,7 gram. Pada keadaan standar volume gas yang dihasilkan di anoda.

Teori Singkat Sel Elektrolisis dan Reaksi Kimia yang Terjadi di Katoda maupun Anoda YouTube
Jika muatan listrik yang masuk sebesar 0,1 F, hitunglah:. Arus listrik yang digunakan 0,5 A dan di katode diendapkan logam nikel dengan massa 11,6 gram (Ar Ni = 58) Tuliskan reaksi yang terjadi!. Jika pada larutan yang berisi CuSO 4 di katode mengendap logam tembaga sebanyak 6,35 gram, tentukan massa perak dan besi yang mengendap pada.
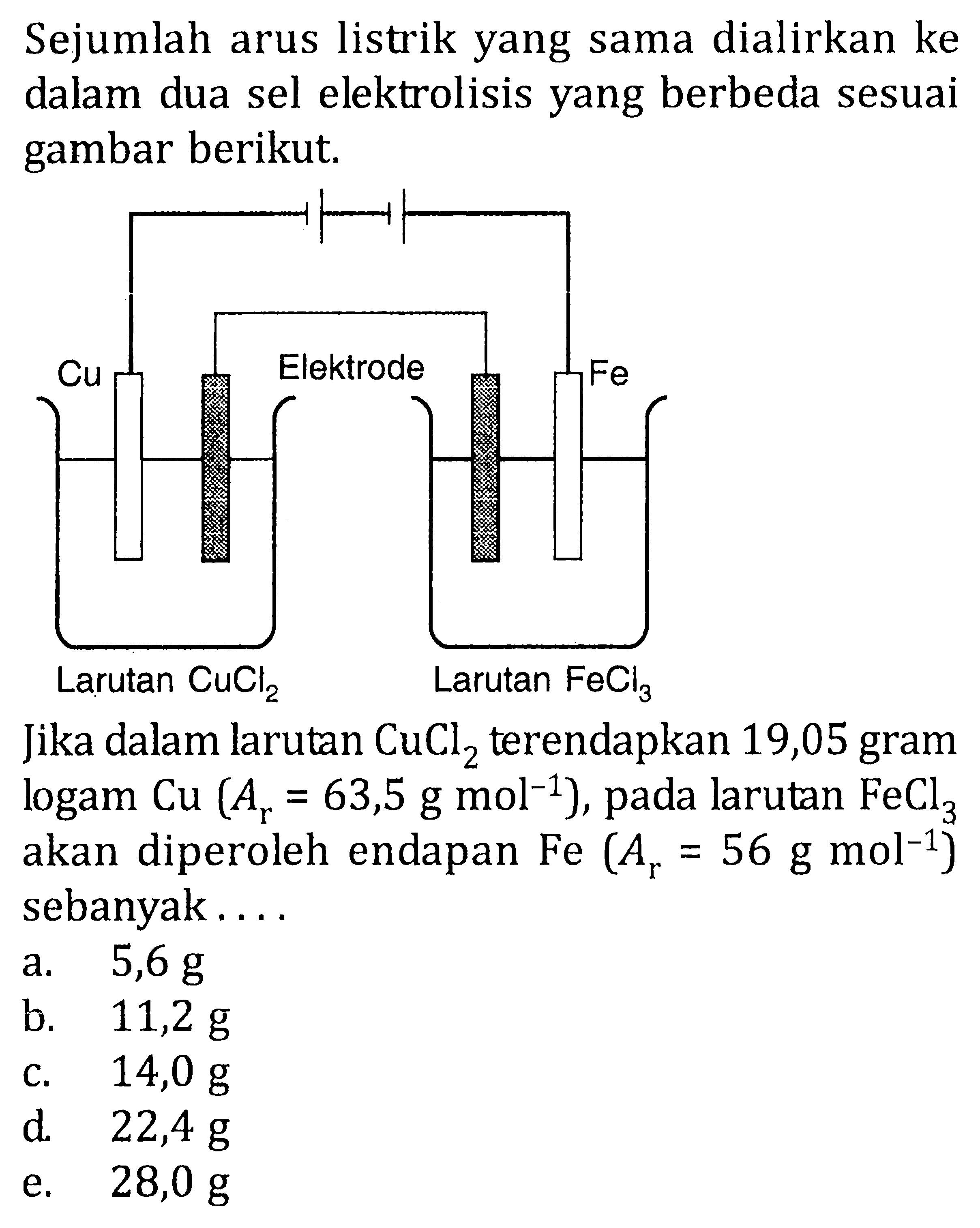
Dalam suatu proses elektrolisis, arus listrik 1930 C dile...
Hitunglah massa tembaga yang dihasilkan jika arus listrik sebesar 10 ampere. Maka, massa Cu yang dihasilkan adalah: Jadi, massa tembaga yang dihasilkan adalah sebesar 31,75 gram. Contoh 2. Berapa emas dan klor yang terbentuk, jika arus listrik 10 A melewati larutan emas(III) klorida selama 6 menit? (Ar Au = 196,73; Ar Cl = 35,45). Diketahui.

Pengertian Tembaga Ilmu Kimia
Jika Di Katoda Diperoleh Tembaga Sebesar 6 35 Gram - Perhatikan proses elektrolisis logam tembaga dengan elektroda Fe berikut! Proses elektrolisis ini membutuhkan waktu 965 detik pada arus 2 A. Tentukan reaksi yang terjadi di katoda dan anoda dan hitung massa logam yang digunakan untuk penyepuhan!

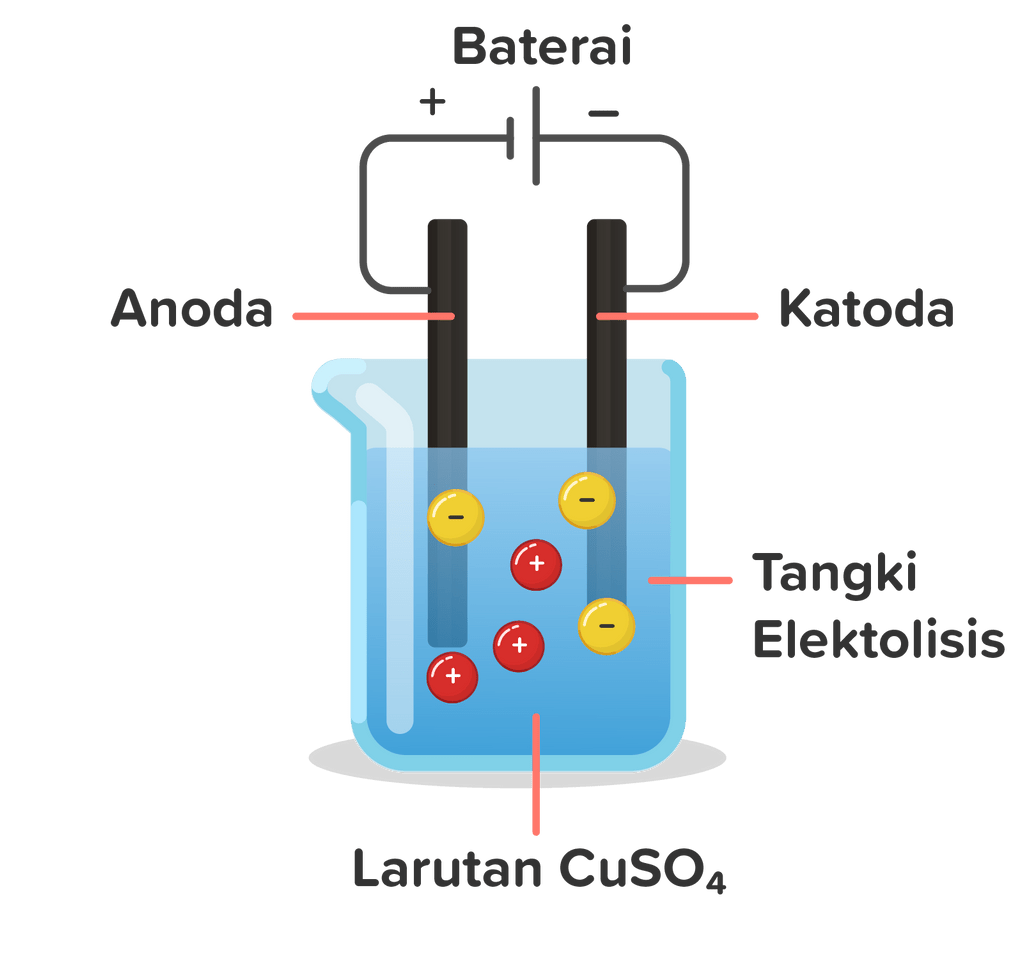
Pada elektrolisis larutan CuSO4 seperti terlihat pada gam...
Reaksi elektrolisis CuSO4 bekerja dengan mendisociasi ion CuSO4 menjadi ion tembaga (Cu2+) dan ion sulfat (SO4 (2-)). Ketika arus listrik dialirkan, ion tembaga berpindah menuju elektroda katoda dan menerima elektron untuk membentuk tembaga. Sementara itu, ion sulfat berpindah menuju elektroda anoda dan kehilangan elektron dalam proses oksidasi.