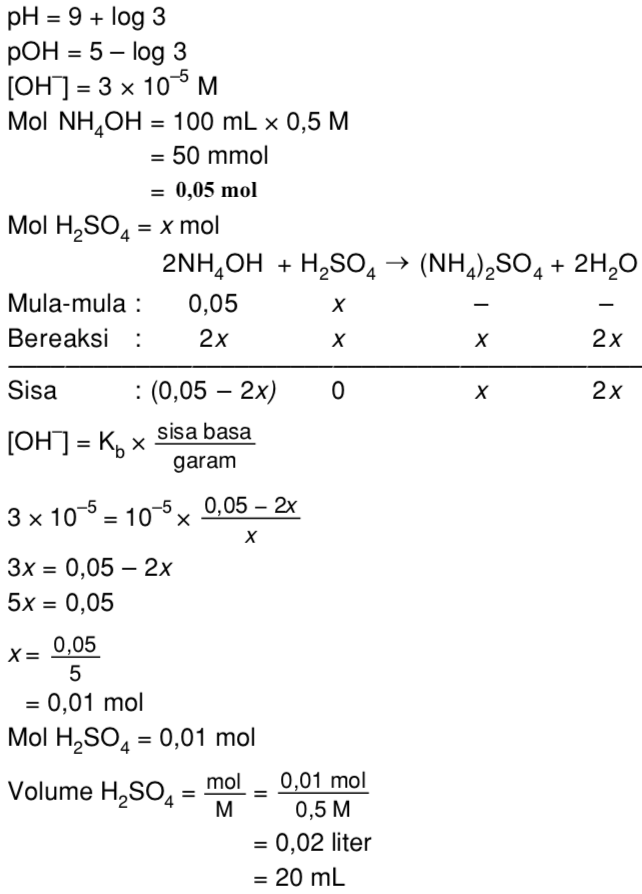
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Terdapat beberapa satuan konsentrasi, yaitu persentase massa (%), persentase volume (%), fraksi mol (X), molalitas (m), molaritas (M). 1.Persentase massa Menyatakan jumlah massa (gram) zat terlarut dalam 100 gram larutan. % massa = x 100% massa1 = massa zat terlarut massa2 = massa pelarut 2. Persentase volume

Fraksi Mol Dan Molalitas M Soal Dan Pembahasan Kimia Kelas 12 Riset
Jika ke dalam 10 mL larutan asam sulfat (H2SO4) 2 M ditambahkan air sebanyak 90 mL, maka konsentrasi larutan asam sulfat sekarang adalah.. Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume Molar. pH Asam Kuat, Basa Kuat, Asam Lemah, dan Basa Lemah. Hukum-Hukum Dasar Kimia dan Stoikiometri.

Hubungan molaritas, massa jenis larutan dan kadar zat YouTube
Jika 150mL H2SO4 10 molal mempunyai massa jenis la. ME Meysha E 15 Agustus 2021 09:39 Jika 150mL H2SO4 10 molal mempunyai massa jenis larutan 1,2 g/mL, maka fraksi mol larutan H2SO4 adalah. 395 3 Jawaban terverifikasi Iklan JS J. Siregar Master Teacher Mahasiswa/Alumni Universitas Negeri Medan 16 Agustus 2021 18:15 Jawaban terverifikasi

Untuk menentukan konsentrasi larutan H2SO4, larutan terse...
100, 0128 ∘ C. 5. 100, 0234 ∘ C. Belajar Modul, Rumus, & Soal Sifat Koligatif Larutan dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Sifat Koligatif Larutan lengkap di Wardaya College.

Perhatikan data titasi asam bawa di bawah ini. Jika massa...
Molalitas dari 100 mL larutan H 2 SO 4 5 M adalah .. . .. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/mL. Berapa kemolalan larutan adalah.. (Mr fruktosa=180). Jika diketahui konsentrasi larutan LiBr dalam asetonitril adalah 1,8 M dan massa jenisnya 0 , 826 g m. 637. 5.0. Jawaban terverifikasi. Untuk.

Kedalam Kalorimeter Sederhana Direaksikan 25 Ml Larutan H2so4 Berkas Soalku
V 1 = volume larutan pekat (L). M 1 = konsentrasi larutan pekat (M). V 2 = volume larutan encer (L). M 2 = konsentrasi larutan encer (M). x = banyak pelarut yang ditambahkan (L) Dengan catatan, V2=V1+x. Kalau sudah ketemu perhitungan yang tepat, elo hanya perlu menuangkan jumlah pelarut yang dibutuhkan ke dalam zat yang akan dilarutkan atau diencerkan.

Cara Menentukan Massa Jenis Zat
Satuan Konsentrasi Larutan; Molalitas dari 100 mL larutan H2SO4 5 M adalah (Mr H2SO4 = 98 dan rho H2SO4 = 1,84 g mL^(-1)). Disediakan 500 mL larutan glukosa (C6H12O6) 0,3 M Jika ma. Tonton video. berarti dibagi 1000 yaitu 0,5 mol ini data pertama kemudian data kedua kita cari massa air kita dapatkan dari mana dari massa larutan maka.

Sebanyak 100 mL larutan H2SO4 0,1 M mempunyai pH
Massa larutan dapat kita hitung dengan rumus, ml = mp + mc = 25 gr + 100 gr = 125 gr Jadi, massa larutannya sebesar 125 gr. Selanjutnya kita hitung konsentrasinya dengan rumus, C = (25 : 125) x 100% C = 0,2 x 100% = 20% Soal No. 2 Diketahui konsentrasi larutan gula dalam air adalah 30%. Massa larutan gula tersebut sebesar 500 gram. Berapakah

Larutan H2SO4 yang kadarnya 98 dan massa jenisnya 1,8 gram cm3 Sebanyak 100 mL diencerkan
Mr x 1000 mL Keterangan simbol 2 rumus diatas sebagai berikut: M = molaritas (mol/liter) n = mol V = volume (L) g = massa (gram) Mr = Massa molekul relatif zat terlarut. mL = volume dalam mililiter Pengenceran larutan Didalam laboratorium, seringkali menemukan larutan yang tersedia mempunyai molaritas tidak sesuai yang kita kehendaki.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
Larutan H2SO4 adalah larutan asam kuat dengan valensi 2, sedangkan NH4OH adalah larutan basa lemah dengan valensi 1. Ketika kedua larutan dicampurkan, maka akan membentuk suatu garam (NH4)2SO4. Untuk menentukan pH nya, adalah sebagai berikut: Menentukan mol masing-masing n H2SO4 = M x V = 50 ml x 0,1 = 5 mmol n NH4OH = M x V = 0,3 M x 50 ml.

Larutan NH4OH 0,1 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4, Mas Soal
Nyatakan ini sebagai mol per kilogram larutan. Sekarang, Anda memiliki 250 ml air, yaitu sekitar 250 g air (dengan asumsi massa jenis 1 g/ml), tetapi Anda juga memiliki 3 gram zat terlarut, jadi massa total larutan mendekati 253 gram daripada 250 Menggunakan 2 angka penting, itu adalah hal yang sama.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
1. Persen massa (%m/m) 2. Persen volume (% V/V) 3. Persen massa per volume (% m/V) 4. Molaritas (M) 5. Molalitas 6. Hubungan antara persen massa dan molaritas 7. Fraksi mol 8. Pengenceran 9. Molaritas campuran Contoh soal 1 Contoh soal 2 Contoh soal 3 Pengertian Larutan

Jika 100 ml larutan H2SO4 0,1 M direaksikan dengan 400 ml larutan NH3 0,05 M ( Kb NH3 = 2 x 105
Jika 150 ml air H2SO4 , 10 molar mempunyai massa jenis larutan 1,2 gr/ml. tentukan fraksi mol H2SO4 Galladeaviero massa 150 mL = 150 x 1.2 = 180 gram m = (w/Mr) (1000/P) 10 = (w/ (2 + 32 + 4 x 16)) (1000/ (180 - w)) w = 89.09 g Fraksi mol H2SO4 adalah, X = (w/Mr)/ (w/Mr + w'/Mr') X = (89.09/98)/ (89.09/98 + (180 - 89.09)/18) X = 15.25%

Rumus Molaritas Yang Ada Massa Jenis Edukasi Lif Co Id My XXX Hot Girl
N1.V1=N2.V2. 36.V1=1.1000. V1=1000.1/36. V1=27,8 ml. Jadi asam sulfat pekat yang dibutuhkan sebanyak 27,8 ml. Sehingga cara pembuatan asam sulfat ( H2SO4 ) 1 N sebanyak 1000 ml adalah : Isi labu takar ukuran 1 liter dengan aquadest kira-kira 250 ml, lalu tambahkan 27,8 ml asam sulfat pekat secara perlahan.

Molalitas dari 100 mL larutan H2SO4 5 M adalah (Mr H2SO4
Suatu larutan mengandung 392 gram H2SO4 tiap liter satuan, massa jenis larutan 1, g/ml. hitung kemolalan larutan tersebut. Hitung molalitas larutan asam oksalat H2C2O4 dalam air, jika fraksi mol asam oksalat tersebut 0,05. Suatu larutan 45%massa dari NaNO3 mempunyai kerapatan 1,368 g/ml. hitunglah molalitas larutan.

jumlah molekul dan persen massa H2SO4 dalam senyawa , kimia sma kelas 10 kurikulum merdeka no 3
Mol zat terlarut M = liter larutan V—jika volume larutan dinyatakan dalam ml maka rumus molaritas dapat dinyatakan dengan: m 1000 M = n x V. Berapa molaritas larutan asam sulfat 95 % (massa) dengan massa jenis 1,2 g/mL? Jawab: Diketahui: massa H2SO4= 95 %. ρ H2SO4= 1,2 g/mL. Mr H2SO4: 98 gr/mol.. Larutan H2SO4 dalam air mempunyai pH=2.