
Larutan Elektrolit dan Non Elektrolit
Perbedaan Larutan Elektrolit dan Non Elektrolit Masmiani dalam uraian "Larutan Elektrolit, Larutan Non Elektrolit, dan Asam Basa" menyatakan bahwa larutan elektrolit mengandung partikel bermuatan kation dan anion. Jika larutan elektrolit dialirkan listrik (elektron), akan terjadi suatu proses yang dinamakan elektrolisis.

SifatSifat Larutan Elektrolit dan Nonelektrolit Memotivasi Diri
Sejarah Larutan Elektrolit Dan Non Elektrolit. Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini.

VIRTUAL LABORATORIUM Larutan Elektrolit dan Non Elektrolit YouTube
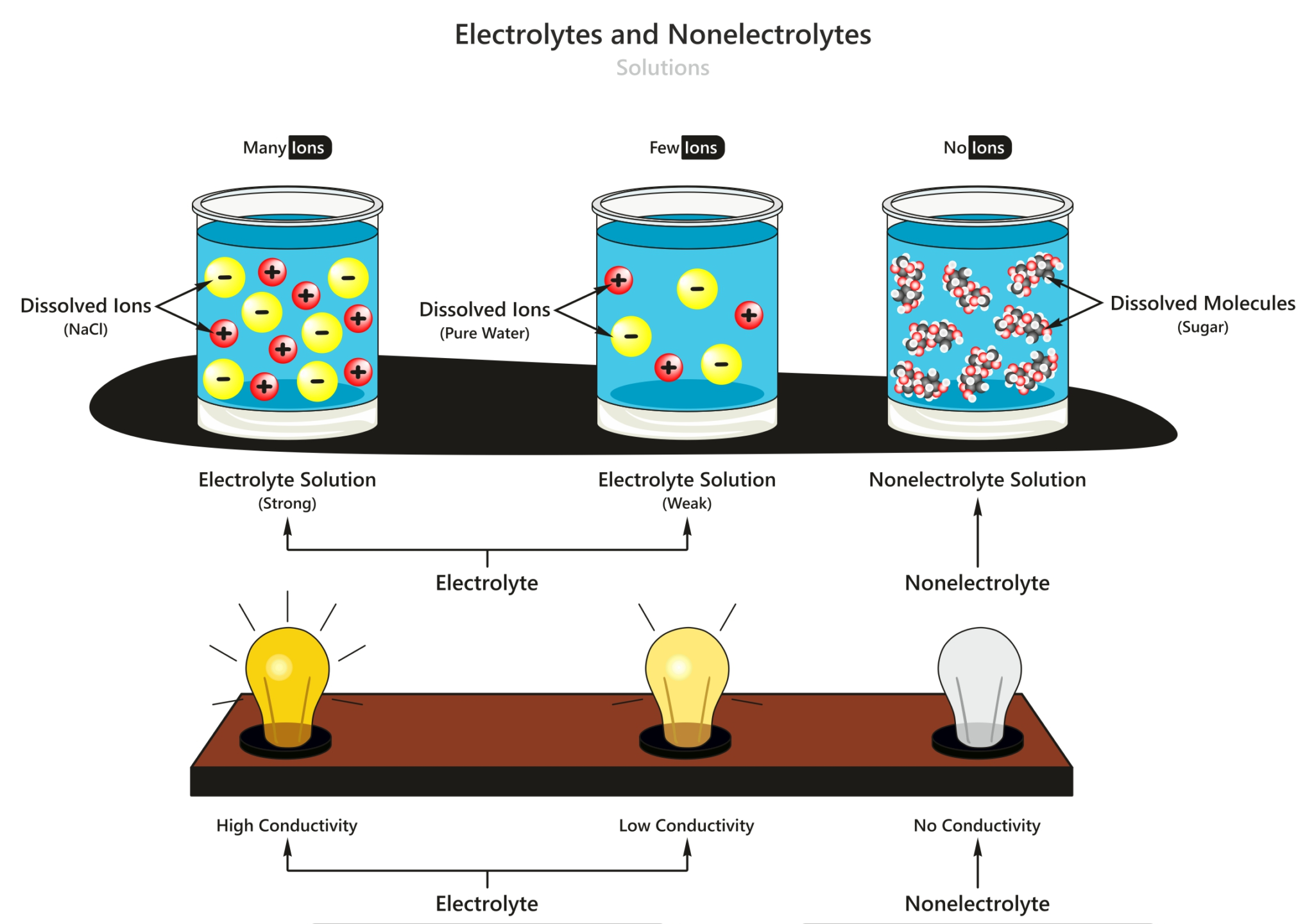
Artinya, larutan non elektrolit tidak mengandung ion-ion (kation atau anion) yang dapat menghantarkan muatan listrik. Dilansir dari Chemistry LibreTexts, hal tersebut karena zat non elektrolit tidak berdisosiasi sama sekali dan rumus kimia zat tersebut tidak berubah selama proses pelarutan. Zat elektrolit cenderung memiliki ikatan kovalen yang.

Larutan Elektrolit dan Non Elektrolit (Kompone
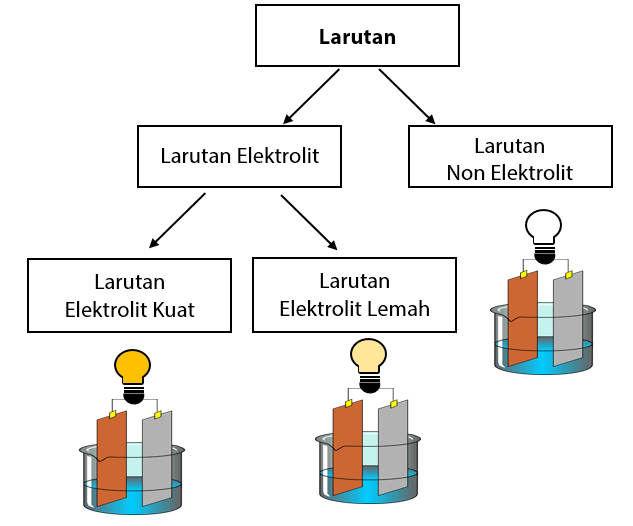
Larutan elektrolit yang memberikan gejala berupa lampu menyala dan membentuk gelembung gas disebut elektrolit kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur. Adapun elektrolit yang tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas termasuk elektrolit lemah. Contohnya yaitu larutan amonia, larutan cuka,dan.

Larutan Elektrolit dan Nonelektrolit
Penghantaran arus listrik. Larutan elektrolit terdapat ion-ion yang berbeda muatan dan bergerak bebas. Bila arus listrik dihubungkan, kation bergerak menuju katode dan anion bergerak menuju anode sehingga arus listrik mengalir dalam sistem tersebut. 5. Sifat - sifat dari larutan elektrolit dan non elektrolit.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Contoh Larutan Non Elektrolit. Larutan selain asam, basa, dan garam, contoh: gula, alkohol, glukosa, urea, dll. Baca Juga : Benzena dan turunannya serta Penjelasannya. Demikian artikel mengenai Larutan ELektrolit dan Non Elektrolit Serta Penjelasannya. Semoga artikel ini dapat bermanfaat dan menambah wawasan anda mengenai pelajaran Ilmu.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
Larutan elektrolit dalam sebuah baterai. Elektrolit adalah suatu zat yang larut atau terurai ke dalam bentuk ion-ion dan selanjutnya larutan menjadi konduktor elektrik, ion-ion merupakan atom -atom bermuatan elektrik. Elektrolit bisa berupa air, asam, basa atau berupa senyawa kimia lainnya. Elektrolit umumnya berbentuk asam, basa atau garam.

Materi Kimia Elektrolit dan Non Elektrolit YouTube
Pada larutan non elektrolit, zat non elektrolit yang terlarut tidak dapat terurai menjadi ion-ion, sehingga tidak terdapat ion-ion bebas yang dapat menghantarkan arus listrik. Sebagai contoh, larutan gula sukrosa (C 12 H 22 O 11 ) merupakan larutan non elektrolit.
Larutan Elektrolit dan Non Elektrolit
Glukosa = C6H12O6. Sukrosa = C12H22O11. Etanol = C2H2OH. Contoh reaksi larutan non-elektrolit. C6H12O6 (s) C6H12O6 (aq) Itulah Ulasan tentang Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan Terima Kasih.

LARUTAN ELEKTROLIT DAN NON ELEKTROLIT YouTube
Pengertian larutan elektrolit. Larutan elektrolit adalah larutan yang dapat mengantarkan listrik sehingga dapat menyalakan lampu atau menimbulkan gelembung gas di sekitar elektrodanya. Baca juga: Pengertian Larutan, Suspensi, dan Koloid. Larutan elektrolit mengandung partikel-partikel yang bermuatan, yakni kation dan anion.

Soal Larutan Elektrolit Dan Nonelektrolit Satu Trik
Larutan seperti ini disebut larutan elektrolit. Sebaliknya, larutan yang tidak bisa menghantarkan arus listrik disebut larutan non elektrolit. Keduanya memiliki manfaat yang sangat penting dalam kehidupan manusia, bahkan larutan elektrolit dibutuhkan tubuh agar organ tubuh, seperti otak, saraf, dan otot dapat berfungsi dengan baik.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
Pengertian Larutan Elektrolit dan Non-Elektrolit Pengertian Larutan Elektrolit. Larutan elektrolit merupakan jenis larutan yang mampu mengalirkan arus listrik karena mengandung ion-ion yang bergerak secara bebas. Keberadaan ion-ion inilah yang bertanggung jawab atas konduktivitas listrik dalam larutan tersebut.. Jelaskan alasan Anda. Jawaban.

Larutan Elektrolit dan Reaksi Redoks Kelas 10 • Part 1 Larutan Elektrolit dan Nonelektrolit
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

30 Contoh Larutan Elektrolit dan Non Elektrolit
1. Larutan elektrolit adalah larutan yang dapat mengkonduktivitas listrik karena adanya ion. 2. Larutan non-elektrolit adalah larutan yang tidak dapat mengkonduktivitas listrik karena tidak mengandung ion. 3. Larutan elektrolit dapat digunakan untuk pembuatan baterai, pengolahan air dan pelarut untuk senyawa kimia. 4.

Larutan elektrolit dan non elektrolit
Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah memiliki derajat ionisasi jauh dibawah 1, berarti zat terlarut yang berubah menjadi ion hanya sedikit. Hal ini menyebabkan larutan elektrolit lemah menghantarkan listrik dengan kurang baik.
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Larutan Elektrolit dan Non-Elektrolit: Sejarah Penemuan Larutan Elektrolit dan Non-Elektrolit. Penemuan larutan elektrolit dan non-elektrolit ternyata berhubungan dengan ilmuwan asal Swedia, Svante August Arrhenius (1859-1927). Kala itu ia tengah melakukan presentasi disertasi untuk gelar PhD-nya di Universitas Uppsala tahun 1884.