
Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Arrhenius menjelaskan asam sebagai zat yang ketika dilarutkan dalam air menghasilkan ion hidronium (H+). Sedangkan basa menurut Arrhenius adalah zat yang dapat menghasilkan ion hidroksida (OH−) ketika dilarutkan dalam air. Contohnya HCl, HBr, NaOH, KOH. Bronsted-Lowry mendeskripsikan asam sebagai zat yang mampu memberikan ion H+ (donor proton.

Teori Asam Basa
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).
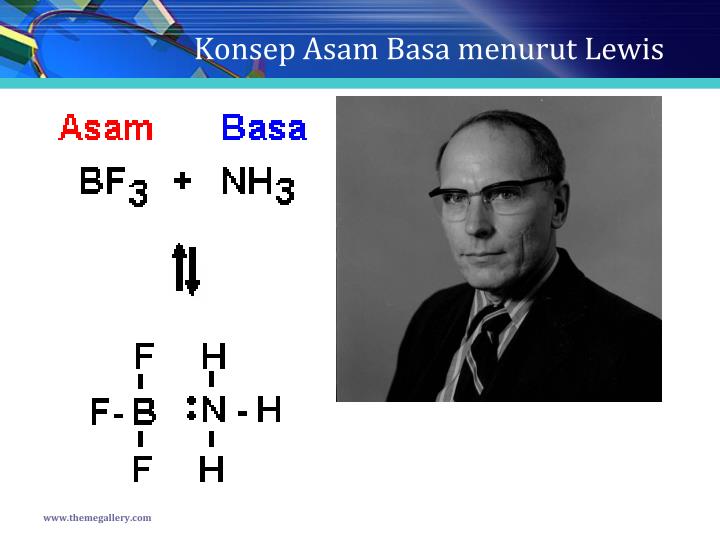
Konsep Asam Basa Menurut Lewis Pengertian Dan Contohnya Jempol Kimia Riset
Reaksi ionisasi basa Arrhenius . 2. Teori Asam Basa Bronsted- Lowry. Pada tahun 1923 Johannes N. Bronsted dan Thomas M. Lowry mengajukan konsep asam basa berdasarkan pemindahan proton (H +) Berikut ini asam basa menurut Bronsted-Lowry: Asam adalah spesi yang dapat memberikan proton atau donor proton (H +)

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Konsep asam basa dari Arrhenius, Bronsted-Lowry, dan Lewis.di video ini juga membahas mengenai keunggulan dan kelemahan setiap teori mereka.Konsep Asam-Basa.

TEORI ASAM BASA ARHENIUS, BRONSTED LOWRY, DAN LEWIS YouTube
Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semua! Selamat datang di channel Cerdas Kimia. Video berisi penjelasan teori Asam Basa 1. Arrhenius 2. Bron.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Berikut penjelasan teori asam dan basa dari Arrhenius, Bronsted-Lowry, dan Lewis: Teori Asam Basa Arrhenius. Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.

LENGKAP ‼️ Teori Asam Basa Lewis Latihan Soal dan Pembahasan YouTube
1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam basa dalam pelarut lain maupun tidak punya pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang punya pasangan elektron bebas atau yang dapat menerima pasangan elektron bebas, semisal pada pembentukan senyawa kompleks.

Teori Asam Basa
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.
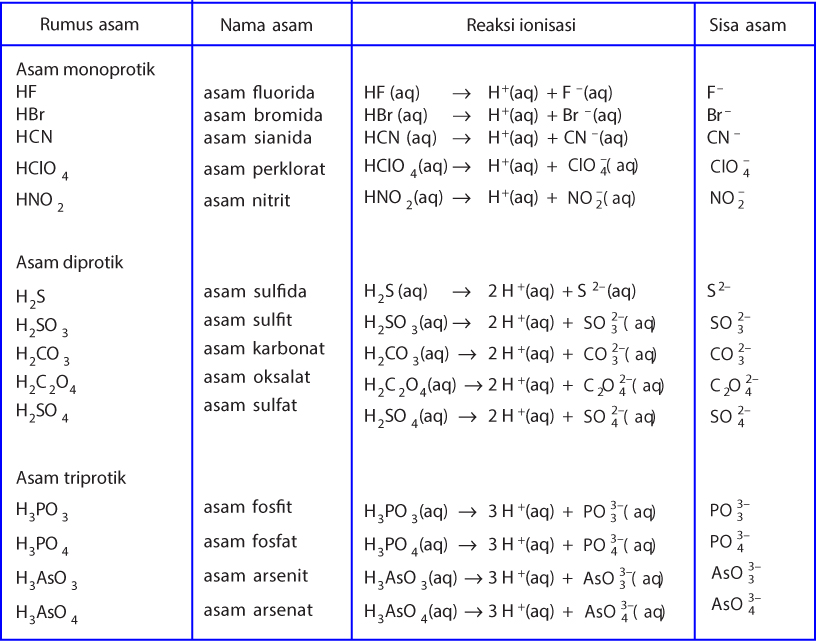
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Kelebihan asam basa Lewis. Teori asam basa Lewis memiliki kelebihan sebagai berikut: 1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam, basa dalam pelarut lain maupun tidak mempunyai pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas.

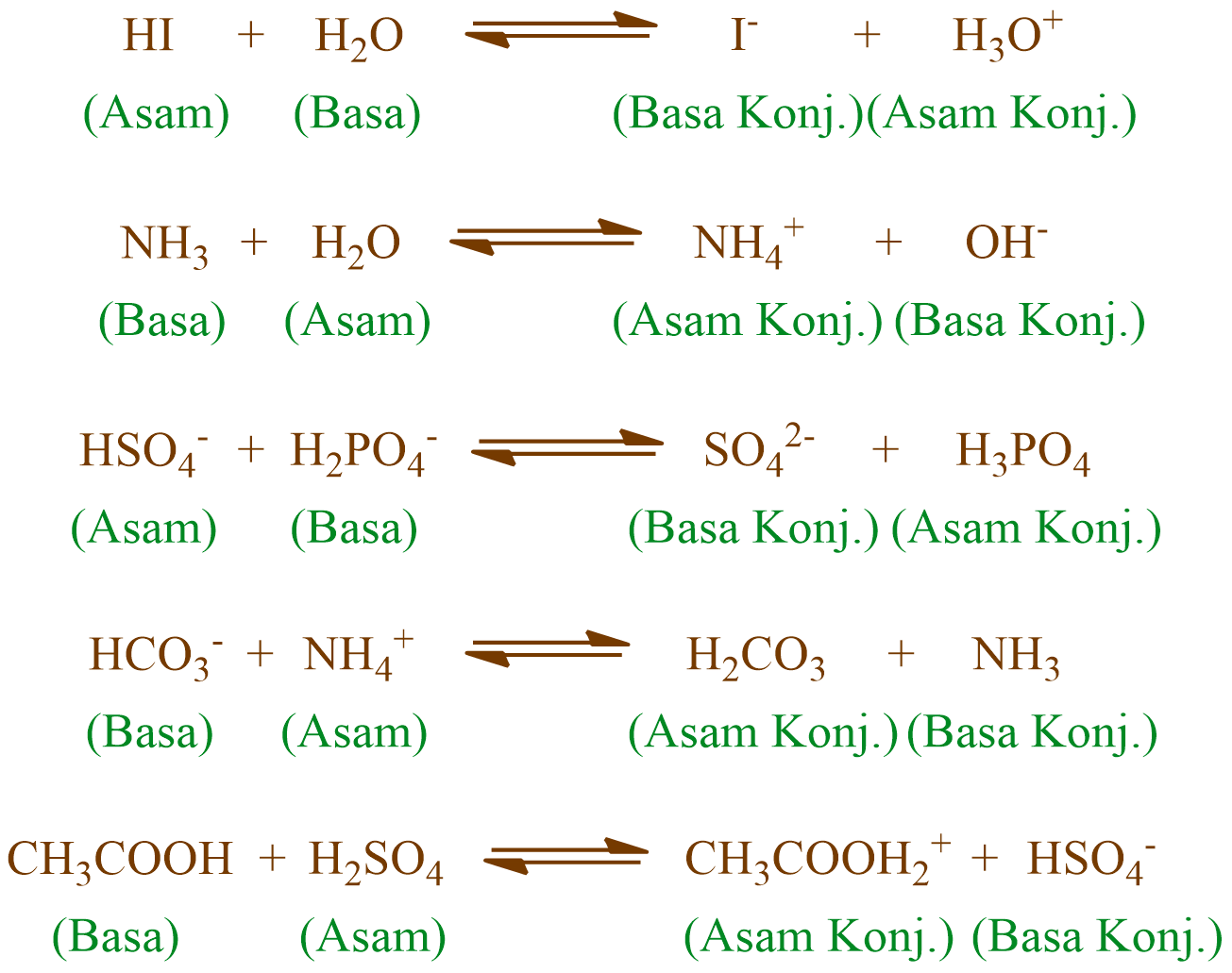
Jelaskan sifat asambasa pada reaksireaksi berikut mengg...
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.
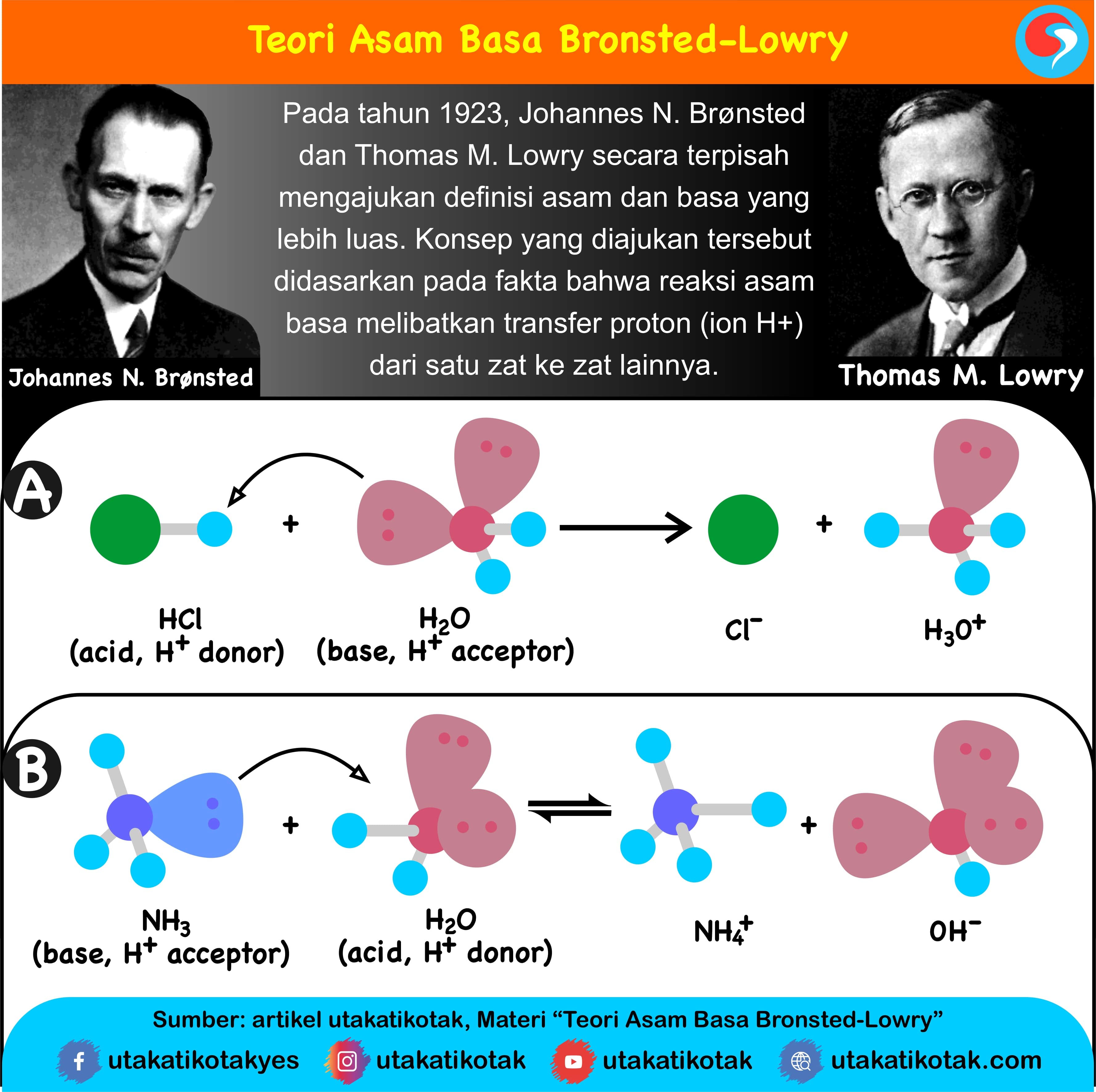
Teori Asam dan Basa Menurut BronstedLowry
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.
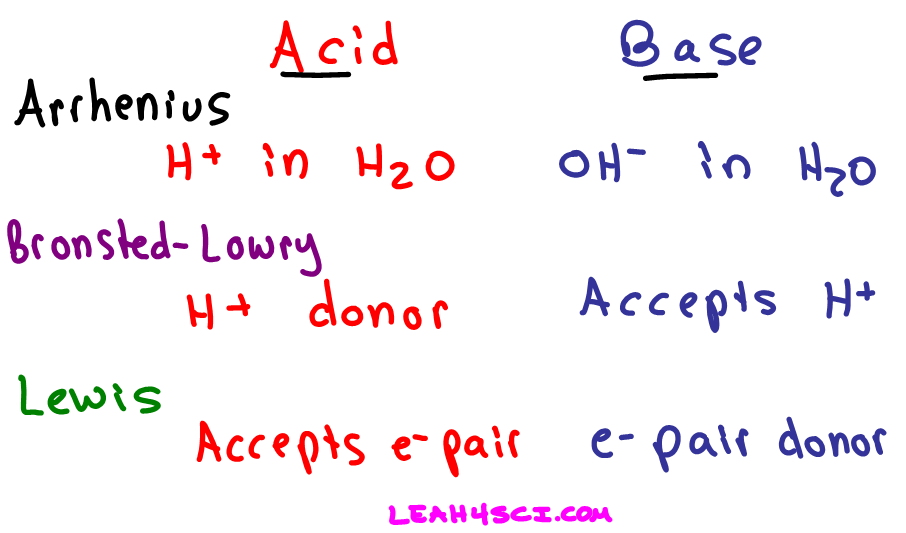
Definitions of Arrhenius, BronstedLowry, and Lewis Acids and Bases in Organic Chemistry
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).
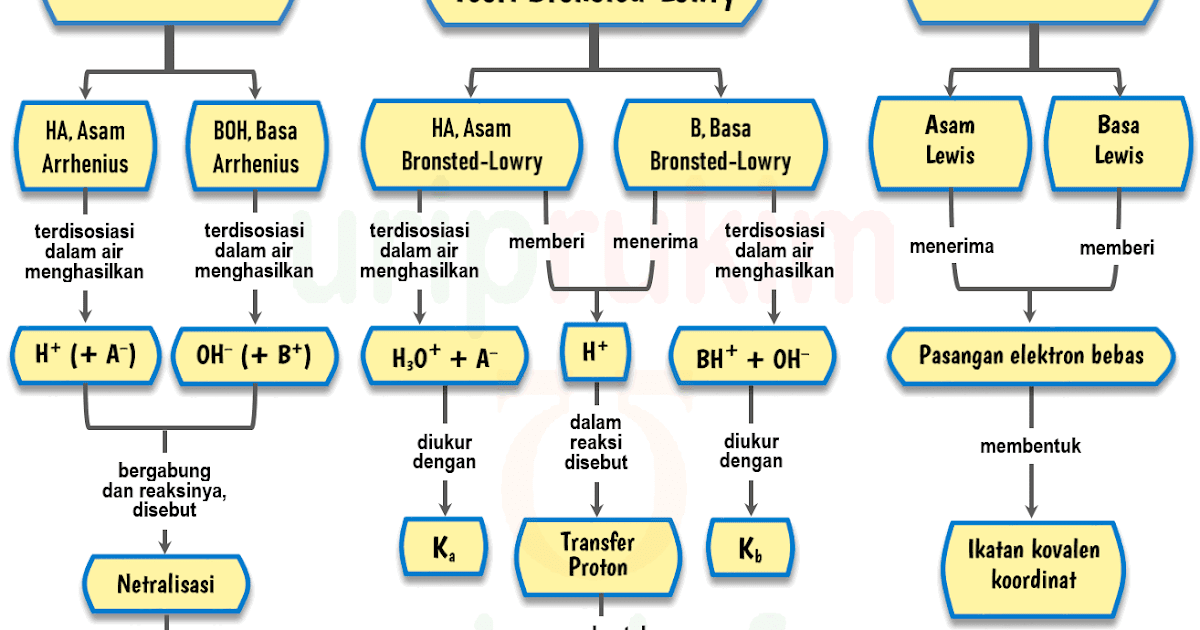
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Konsep asam basa dapat dijelaskan melalui tiga konsep, yaitu konsep Arrhenius, Bronsted-Lowry, dan Lewis. Konsep Arrhenius menjelaskan sifat asam-basa dalam air. Menurut konsep Arrhenius, asam adalah zat yang dapat melepaskan ion hidrogen (H+) ketika dilarutkan dalam air.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Basa menurut Arrhenius adalah senyawa yang jika dilarutkan dalam air akan menghasilkan ion. Basa menurut Bronsted-Lowry adalah penerima/akseptor proton () Asam menurut Lewis adalah penerima/akseptor Pasangan Elektron Bebas (PEB) Basa menurut Lewis adalah pemberi/donor Pasangan Elektron Bebas (PEB).