
Contoh Soal Hidrolisis Asam Lemah Dan Basa Lemah
1. Asam asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom.
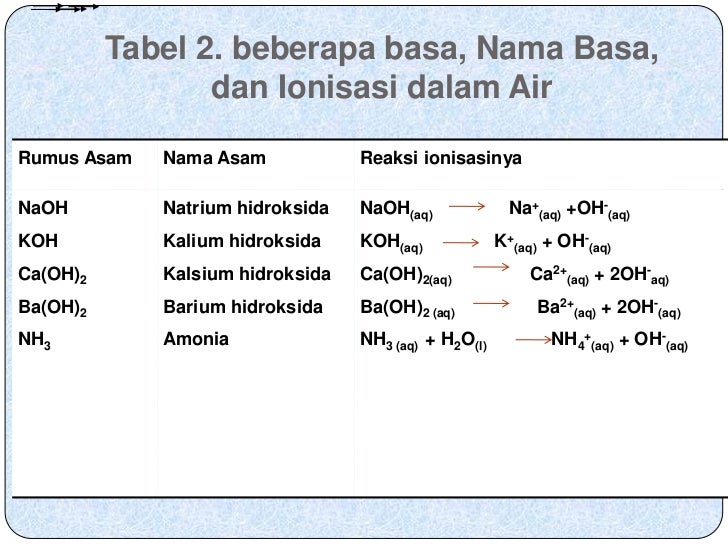
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Hidrogen sulfida, H 2 S, adalah gas yang tidak berwarna, beracun, mudah terbakar dan berbau seperti telur busuk. Gas ini dapat timbul dari aktivitas biologis ketika bakteri mengurai bahan organik dalam keadaan tanpa oksigen ( aktivitas anaerobik ), seperti di rawa, dan saluran pembuangan kotoran. Gas ini juga muncul pada gas yang timbul dari.

Cara Menghitung Ph Asam Lemah Satu Manfaat
Air Liquide officially opened its largest liquid hydrogen production and logistics infrastructure facility in North Las Vegas, Nevada. The facility aims to supply the growing needs for hydrogen mobility, but will also allow to provide hydrogen to a wide array of industries while the mobility market continues to mature.
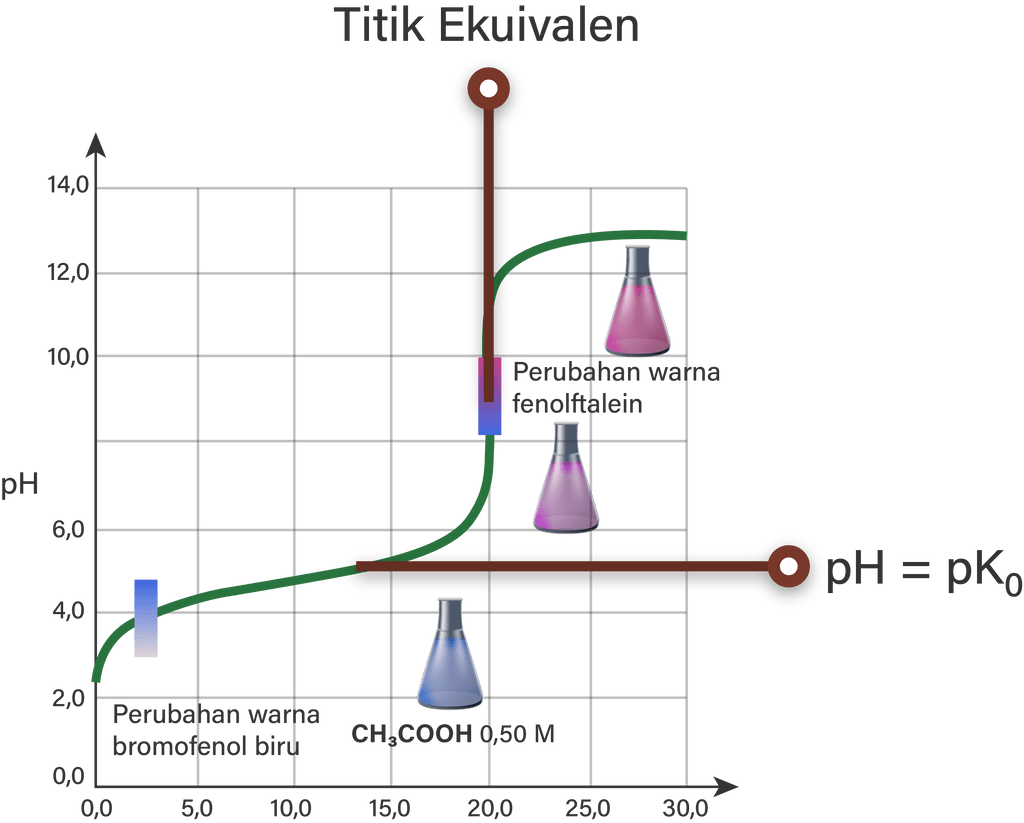
Contoh titrasi asam lemah dengan basa kuat adalah
Artinya, perbedaan asam lemah dan asam kuat adalah asam kuat terdisosiasi sempurna dalam air, sedangkan asam lemah hanya terdisosiasi sebagian. Menurut Shikha Munjal dan Aakash Singh dalam The Arrhenius Acid and Base Theory (2020), asam kuat memiliki konsentrasi ion hydronium yang terbentuk sama dengan konsentrasi asam.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Asam sulfida (H2S) 21. Asam fosfit (H3PO3) 22. Asam fosfat (H3PO4) 23. Asam arsenit (H3AsO3). Untuk sederhananya di SMA biasanya disebutkan apabila mempunyai Ka atau Kb berarti itu asam atau basa lemah.. nanti langsung akan ketahuan pH nya berapa. kalau pH 1 atau mendekati berarti asam kuat, kalau pH 14 atau mendekati berarti basa kuat. salam
Daftar Asam Basa Kuat Dan Lemah
Daftar Nama Asam-Basa Kuat & Lemah. Asam dan Basa memiliki tingkat kekuatan yang berbeda beda. tingkat keasaaman dapat diukur dengan pH. secara umum pH memiliki range dari 1 - 14. semakin rendah pH maka asam akan semakin kuat dan semakin tinggi pH maka tingkat keasaman akan semakin rendah (semakin basa). pH bisa diukur menggunakan Indikator.

pH Campuran asam Lemah dan Asam KuatKimia SMA YouTube
Tabel Nilai Ka Umum untuk Asam Lemah. K a adalah tetapan kesetimbangan untuk reaksi disosiasi asam lemah . Asam lemah adalah asam yang hanya terdisosiasi sebagian dalam air atau larutan berair. Nilai K a digunakan untuk menghitung pH asam lemah . Nilai pKa digunakan untuk memilih buffer saat dibutuhkan. Memilih asam atau basa di mana pKa.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Contoh asam kuat dan asam lemah - Asam (yang sering diwakili dengan rumus umum HA) secara umum merupakan senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7.Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H+) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron bebas dari suatu basa.

H2S Asam Atau Basa
Contoh Asam Kuat dan Lemah Contoh asam kuat.. Asam fosfat atau H3PO4 adalah asam lemah yang sering digunakan sebagai reagen kimia dan beberapa kegunaan lainnya. Seperti pada ortopedik dan etchant gigi, aditif makanan, pendispersi, fluks, inhibitor karat elektrolit, bahan baku pupuk, hingga dalam produk pembersih rumah..

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Cara membedakan asam kuat dan asam lemah. Nilai konstanta kesetimbangan reaksi disosiasi menunjukkan apakah suatu asam kuat atau lemah . Artinya, konstanta disosiasi asam K a , adalah konstanta kesetimbangan reaksi disosiasi asam dalam media berair (parameter logaritmik juga digunakan, pK a =-logK a ). Nilai K a besar untuk asam kuat (dan pK a.

H2S Asam Atau Basa
1. Asam Kuat - Kekuatan Asam Kuat dan Asam Lemah. Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut. HA(aq) → H+(aq) + A-(aq) Dengan: x = valensi asam. M = konsentrasi asam.
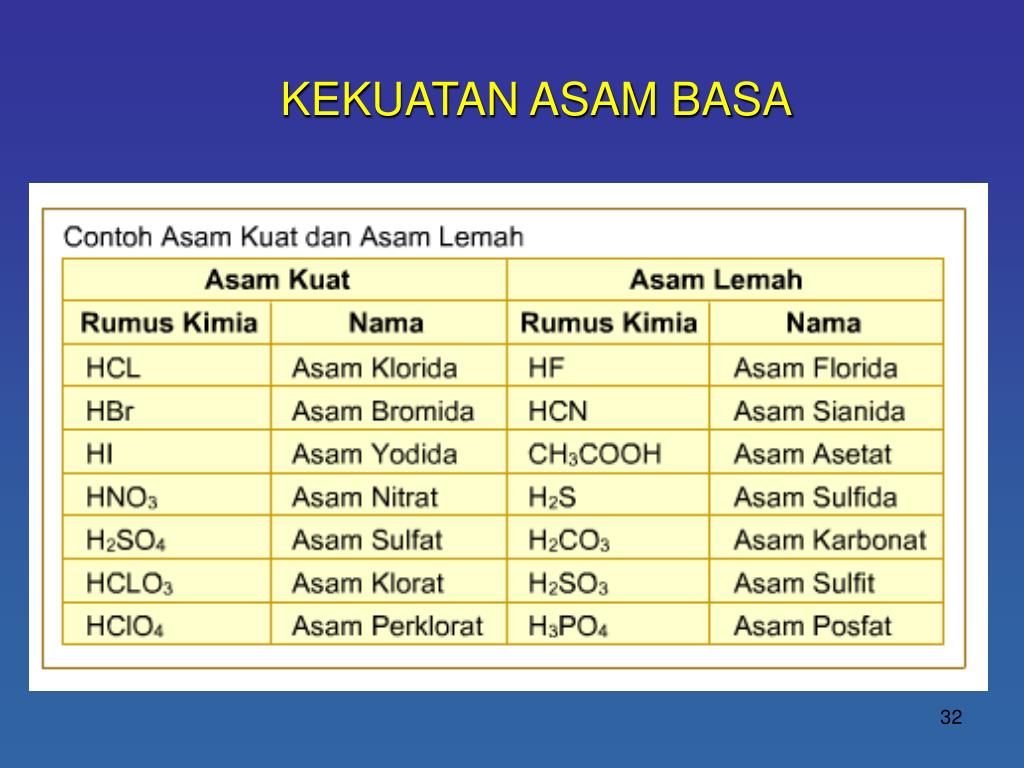
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Mengapa Asam Hidrofluorat Adalah Asam Lemah. Asam fluorida adalah satu-satunya asam hidrohalat (seperti HCl, HI) yang bukan asam kuat. HF terionisasi dalam larutan berair seperti asam lainnya: HF + H 2 O H 3 O + + F -. Hidrogen fluorida sebenarnya larut cukup bebas dalam air, tetapi ion H 3 O + dan F - sangat tertarik satu sama lain dan.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Asam Lemah. Asam lemah tidak sepenuhnya terdisosiasi menjadi ion-ionnya dalam air. Sebagai contoh, HF berdisosiasi menjadi ion H + dan F - dalam air, tetapi beberapa HF tetap berada dalam larutan, sehingga bukan merupakan asam kuat. Ada lebih banyak asam lemah daripada asam kuat. Sebagian besar asam organik adalah asam lemah.
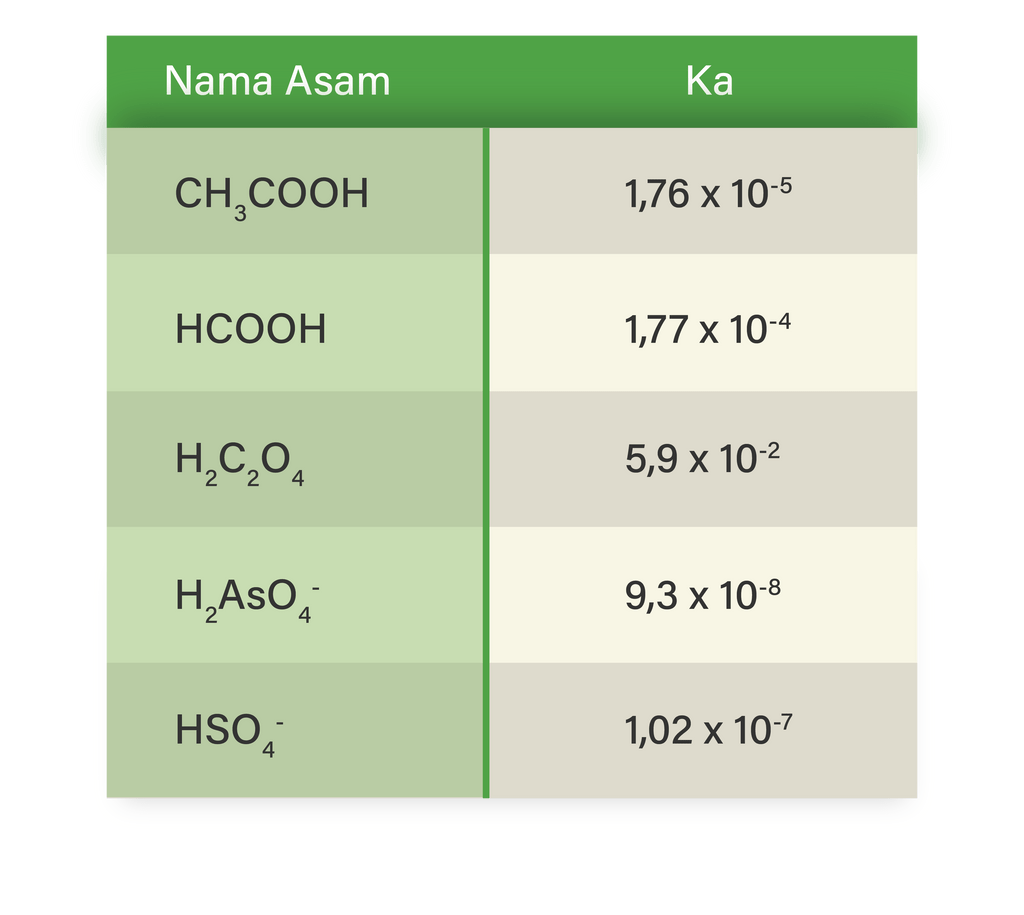
Diketahui nilai K a dari beberapa asam lemah ada...
Hidrogen sulfida (H2S) merupakan asam lemah. Ia tidak terdisosiasi sempurna dalam air, yang berarti hanya sebagian kecil molekul H2S yang terionisasi menjadi ion hidrogen (H+) dan ion sulfida (S) 2-.Sebagai asam lemah, ia memiliki konsentrasi ion H+ lebih rendah dan pH lebih tinggi dibandingkan asam kuat.. Ya, itu hanya jawaban sederhana.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Skala pH yang menunjukan suatu larutan bersifat asam atau basa (lumenlearning.com) KOMPAS.com - Asam merupakan zat yang menghasilkan ion hidrogen (H+) dalam larutan. Sementara basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Kekuatan asam. Asam kuat. Asam lemah. Ringkasnya, asam sulfat (H 2 SO 4 ) adalah asam kuat yang hampir terdisosiasi sempurna menjadi ion hidrogen (H+) dan ion sulfat (SO 4 ) 2- dalam air. Ini menghasilkan konsentrasi ion H+ yang tinggi, menghasilkan pH yang sangat rendah dan sifat yang sangat korosif. Di sisi lain, asam lemah yang diwakili oleh.