
2 Contoh Soal Fraksi Mol Terlarut 2 Contoh Soal Fraksi Mol Terlarut Rumus fraksi mol zat
Np = jumlah mol zat pelarut. Jumlah fraksi mol zat terlarut dan zat pelarut yaitu 1. Xt + Xp = 1. Contoh Fraksi Mol. Misalkan pada sebuah larutan yang terbuat dari 5,85 gram garam dapur ( Mr = 58,5 ) yang di larutkan ke dalam 120 gram air ( Mr = 18 ). Maka suatu fraksi mol garam dapur dan fraksi mol air tersebut dapat dihitung dengan cara berikut :

KIMIA KELAS XII Fraksi Mol Pelarut & Fraksi Mol terlarut. YouTube
Postingan ini membahas contoh soal molalitas dan fraksi mol yang disertai pembahasannya atau penyelesaiannya. Molalitas adalah jumlah mol zat terlarut didalam setiap 1 kg atau 1000 gram pelarut. Sedangkan fraksi mol menyatakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Rumus molalitas Rumus molalitas sebagai berikut: m = jumlah mol zat terlarut jumlah kg

Menghitung Fraksi Mol Kelas 12 Soal & Pembahasan [Dilengkapi Konsep Mudah] YouTube
Nt : Jumlah mol zat terlarut; Fraksi mol zat palarut (Xp) biasa dirumuskan dengan rumus seperti berikut ini: rumus fraksi mol zat pelarut.. Hubungan antara Molalitas dengan Persen massa. Persen massa ialah satuan konsentrasi yang juga dapat digunakan didalam larutan kimia. Contohnya ialah larutan yang biasa kita jumpai sehari-hari yaitu larutan.

Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol YouTube
Jumlah fraksi mol zat terlarut dan pelarut adalah 1: X A + X B = 1. atau secara umum fraksi mol dapat dapat dirumuskan sebagai berikut: X = (mol zat pelarut / mol pelarut) = n 1 / (n 1 + n 2) Fraksi Mol Zat Terlarut (Xt) Fraksi mol zat terlarut (Xt) yang dirumuskan dengan rumus seperti berikut ini: Xt = (nt / nt + np) Fraksi Mol Zat Pelarut (Xp)

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.

Contoh Soal Fraksi Mol
Xp = Fraksi mol pelarut Xt = Fraksi mol terlarut P° = Tekanan uap jenuh dari zat pelarut murni (mmHg) P = Tekanan uap larutan (mmHg) Contoh Soal Penurunan Tekanan Uap dan Penyelesaian Tentukan tekanan uap jenuh air pada larutan yang mengandung 12 % massa urea CO(NH 2) 2, jika diketahui Mr = 60 gram/mol. Penyelesaian: Kenaikan titik didih (∆Tb)

Cara Menentukan Massa Jenis Zat
Fraksi mol adalah perbandingan antara jumlah zat suatu komponen (bisa pelarut maupun zat terlarut) dan jumlah zat total atau mol zat totalnya. Mol zat total meliputi mol pelarut dan mol zat terlarut. Di dalam Kimia, penentuan fraksi mol merupakan hal yang paling penting untuk dilakukan. Mengingat, semua sifat-sifat fisik dari suatu larutan.

Larutan asam klorida 18,25 mempunyai massa jenis 1,1 g/mL. Tentukan fraksi mol masingmasing
Konsentrasi Larutan: Pengantar, Persen Massa, Molaritas, Molalitas, Fraksi Mol [Lengkap+Contoh Soal] Ditulis oleh Husnul Khatimah • 17 Februari 2024. Banyaknya zat terlarut dalam larutan dinyatakan dengan konsentrasi larutan yang terdiri dari persen massa, molaritas, molalitas, dan fraksi mol. Pada artikel ini akan membahas materi konsentrasi.

Contoh Soal Fraksi Mol Dan Pembahasannya
1. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat pelarut dalam larutan tersebut adalah…. a. 0,4 mol. b. 0,5 mol. c. 0,6 mol. d. 0,8 mol. e. 1,0 mol. Jawaban: Diketahui: X t.

Contoh Soal Dan Pembahasan Fraksi Mol Soal Kelasmu
Jika larutan diuapkan sebagian, maka mol fraksi dari masing-masing penyusun larutan tidak sama karena volatilitas (mudahnya menguap). hubungan antara jumlah zat terlarut dengan tekanan uapnya merupakan fungsi linier (semakin banyak solute, maka tekanan uap akan semakin kecil), sedangkan pada larutan yang tidak encer,.
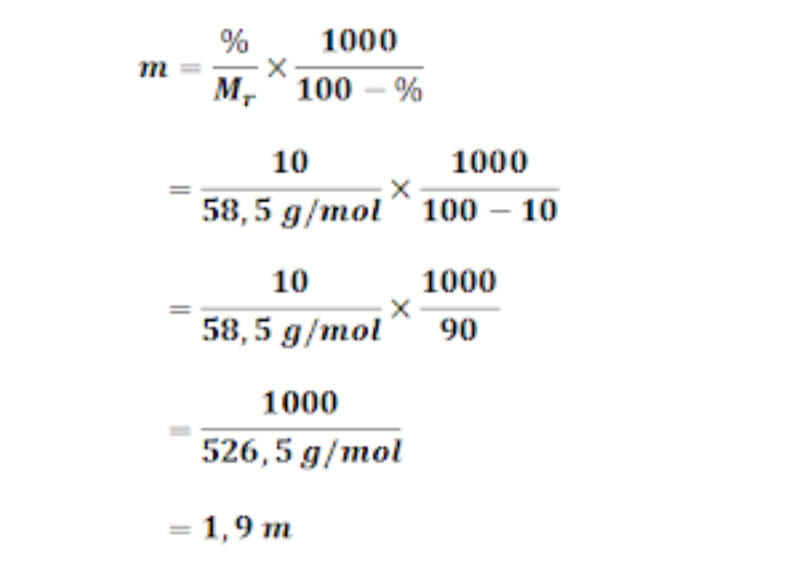
Cara Menghitung dan Contoh Soal Fraksi Mol dan Jawabannya Rumus dan Pembahasan Fraksi Mol
Persen atau kadar massa merupakan adanya jumlah zat liter yang terlarut dalam 100 liter larutan. Fraksi Mol Larutan (Xt) Merupakan perbandingan antara mol zat terlarut (zt) terhadap jumlah mol zat terlaut (zt) dan mol pelarut (p). Fraksi Mol Pelarut (Xp)

Kumpulan Contoh Soal Fraksi Mol dan Pembahasannya Terbaru 2022 Halaman 4
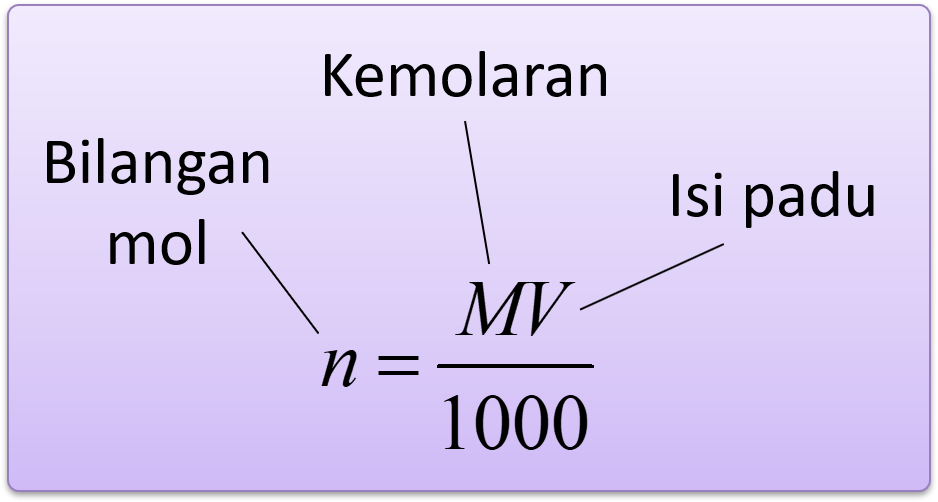
Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas Dalam larutan, terdapat beberapa sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut. Oleh karena sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut, maka perlu diketahui tentang konsentrasi larutan. Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat.

Larutan etanol (Mr etanol = 46) memiliki fraksi mol zat t...
KOMPAS.com - Dilansir dari Encyclopedia Britannica (1999), Fraksi mol merupakan salah satu satuan konsentrasi larutan selain molalitas dan juga molaritas. Fraksi mol adalah perbandingan jumlah mol suatu zat (nt) dalam larutan dengan jumlah mol seluruh zat (np) dalam larutan. Fraksi mol dirumuskan sebagai berikut: persamaan fraksi mol terlarut.

Contoh soal Fraksi mol dan penyelesaiannya .. YouTube
Pengertian Fraksi Mol. Fraksi mol adalah besaran konsentrasi larutan. Fraksi mol menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol larutan. Fraksi mol tidak memiliki satuan, sehingga dinotasikan dengan X. Contohnya fraksi mol urea 01, ditulis dengan X urea 0,1. Artinya, larutan yang mengandung 0,1 bagian mol urea dalam 1.
Menghitung Amaun Zat Terlarut Kimia SPM
Simbol dari fraksi mol ini adalah huruf X kapital. Rumus dari fraksi mol adalah sebagai berikut. Keterangan: X t = fraksi mol zat terlarut. X p = fraksi mol zat pelarut. n t = mol zat terlarut. n p = mol zat pelarut. Kadar Zat Terlarut (%) Untuk kadar zat terlarut, kita bisa dibedakan lagi menjadi dua, yaitu kadar massa dan kadar volume.

Kumpulan Soal Fraksi Mol Terlarut Dan Pelarut Lengkap Dengan Pembahasan Riset
Pengertian Fraksi Mol. Dikutip dari buku 'Cerdas Belajar Kimia' terbitan Grafindo, fraksi mol adalah pernyataan konsentrasi suatu larutan yang menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol total komponen larutan (jumlah mol pelarut + jumlah mol zat terlarut).