
Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
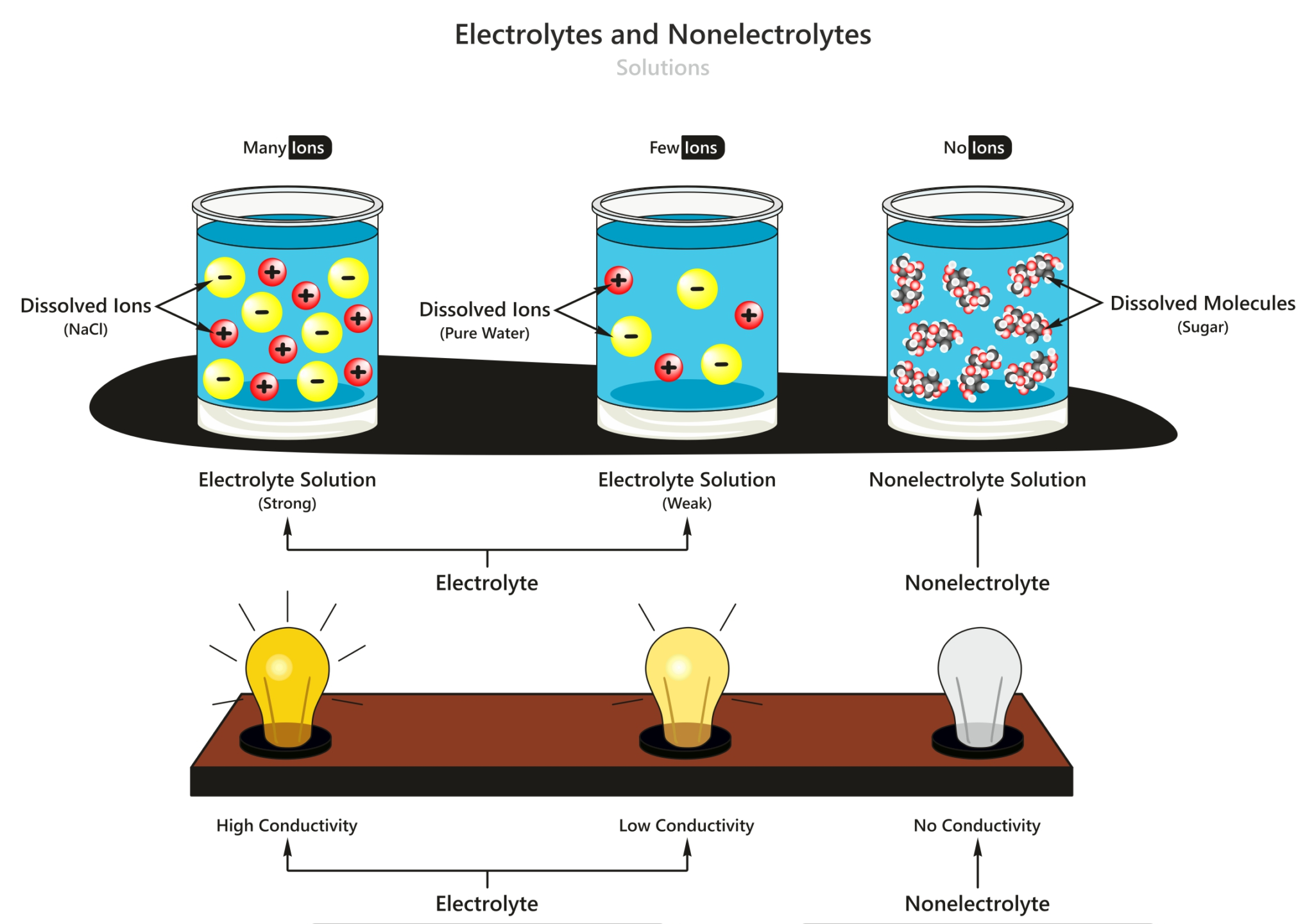
KOMPAS.com - Elektrolit adalah salah satu zat yang penting dalam kehidupan. Secara garis besar larutan elektrolit terbagi menjadi dua, yaitu larutan elektrolit kuat dan lemah. Berikut adalah contoh larutan elektrolit kuat dan lemah!. Larutan elektrolit kuat. Dilansir dari Chemistry Libretexts, larutan elektrolit kuat adalah larutan yang zat terlarutnya terurai sempurna menjadi ion-ion.

Perbedaan Larutan Elektrolit Dan Non Elektrolit
Baca juga: Larutan Elektrolit dan Ikatan Kimia. Larutan elektrolit dibedakan berdasarkan kekuatannya dalam menghantarkan listrik menjadi larutan elektrolit lemah dan larutan elektrolit kuat. Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah.
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Berikut adalah manfaat larutan non elektrolit. 1. Sebagai sumber energi. Gula adalah salah satu komponen larutan non elektrolit. Gula ini merupakan sumber energi dalam bentuk karbohidrat sederhana. Ketika tubuh manusia kekurangan gula, maka akan terasa lelah, jantung berdebar, dan sulit berkonsentrasi.

Detail Contoh Elektrolit Kuat Dan Lemah Koleksi Nomer 6
Pengertian Larutan Elektrolit dan Non-Elektrolit. Perbedaan utama antara larutan elektrolit kuat dan elektrolit lemah adalah sejauh mana disosiasi ionik terjadi dalam larutan. Contoh Larutan Elektrolit Kuat: Asam klorida (HCl) adalah contoh larutan elektrolit kuat. Saat larutan HCl larut dalam air, semua molekulnya terionisasi sepenuhnya.
Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10 Belajar
Penyusun LARUTAN ELEKTROLIT & NON-ELEKTROLIT II. Discover the world's research. 25+ million members;. Membedakan larutan elektrolit lemah dan el ektrolit kuat . Karakter yang dikembangakan. 1.

Ciri Ciri Larutan Elektrolit Kuat Lemah Dan Non Elektrolit Larutan Elektrolit Dan Non
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Larutan Elektrolit dan Non-Elektrolit: Sejarah Penemuan Larutan Elektrolit dan Non-Elektrolit. Penemuan larutan elektrolit dan non-elektrolit ternyata berhubungan dengan ilmuwan asal Swedia, Svante August Arrhenius (1859-1927). Kala itu ia tengah melakukan presentasi disertasi untuk gelar PhD-nya di Universitas Uppsala tahun 1884.

Menentukan Elektrolit Kuat dan Elektrolit Lemah (2) YouTube
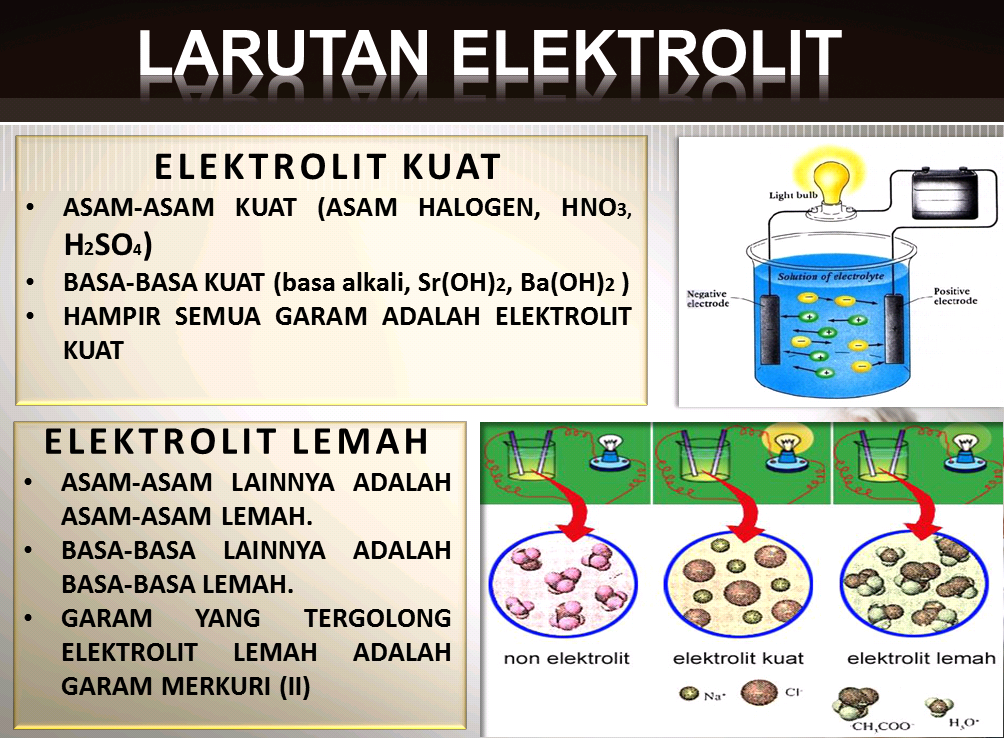
Elektrolit lemah, dan Non Elektrolit Larutan elektolit kuat adalah Larutan yang dapat menghantarkan arus listrik, menghasilkan gelembung yang banyak, bersifat irreversible (dalam satu arah reaksi), memiliki nilai ionisai = 1 dan mengandung komponnen asam kuat/basa lemah + asam lemah/basa lemah

Ppt Larutan Elektrolit Dan Non Elektrolit web site edukasi
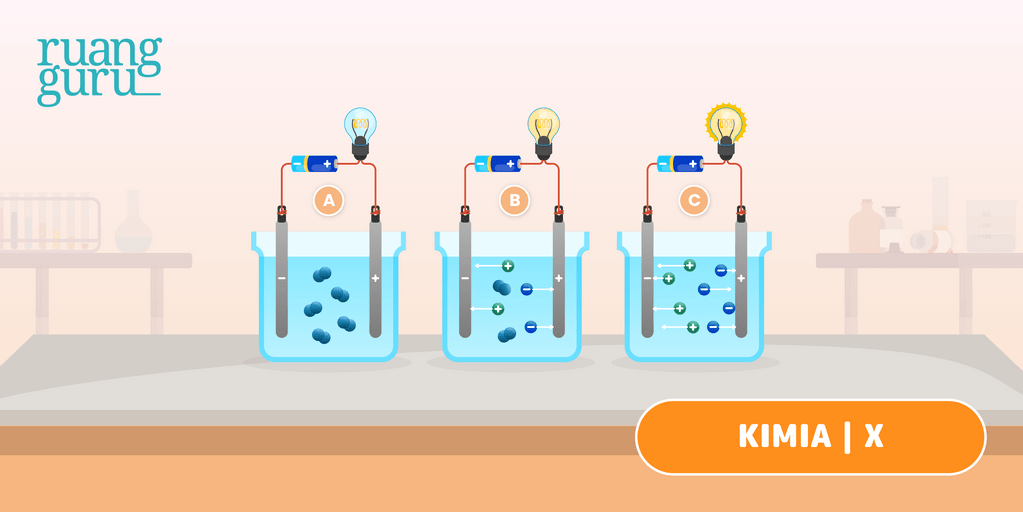
Dan menggunakan alat voltmeter sebagai pengukur tegangan listrik yang dimiliki. Maka beberapa larutan uji tersebut digolongkan kedalam tiga golongan yaitu, larutan elektrolit kuat, larutan elektrolit lemah dan larutan non elektrolit. Baca Juga : Kategori Laporan selain Laporan Praktikum Elektrolit dan Non Elektrolit
Contoh Larutan Elektrolit Dan Non Elektrolit Lengkap Berbagai Contoh
3. Stoikiometri (Perhitungan Kimia) 4. Larutan Elektrolit dan Nonelektrolit. 5. Reaksi Redoks (Reduksi-Oksidasi) Dalam kehidupan sehari-hari, kita sering mendengar kata larutan. Peran larutan sangat penting di antaranya adalah cairan tubuh kita yang mengandung komponen larutan dari berbagai zat kimia, mineral yang terdapat di kulit bumi.

Naoh Elektrolit Kuat Atau Lemah
Contoh larutan elektrolit lemah yaitu senyawa-senyawa asam lemah dan basa lemah, seperti H 2 C 2 O 4, CH 3 COOH, N 2 H 4, dan NH 3. Secara kuantitatif, kuat lemahnya elektrolit dapat dinyatakan sebagai derajat ionisasi / derajat disosiasi, α.

Contoh Larutan Elektrolit Kuat Lemah Beserta Perbedannya Riset
Contoh larutan elektrolit kuat yaitu senyawa-senyawa garam mudah larut dalam air, basa kuat, dan asam kuat, seperti NaCl, KBr, CuCl 2, Ca(NO 3) 2, (NH 4) 2 S, NaOH, Ba(OH) 2, HCl, dan H 2 SO 4. Sedangkan, pada elektrolit lemah, elektrolit hanya dapat terurai sebagian kecil menjadi ion-ion dalam pelarutnya.

Elektrolit Kuat dan Elektrolit Lemah (Kimia SBMPTN, UN, SMA) YouTube
Penjelasan singkat mengenai dasar teori elektrolit dan non elektrolit dalam kimia. Temukan jawabanmu di sini!. Elektrolit terbagi menjadi dua jenis, yaitu elektrolit kuat dan elektrolit lemah. Elektrolit kuat sepenuhnya terionisasi dalam larutan, yang berarti semua partikelnya terurai menjadi ion-ion. Sedangkan, elektrolit lemah hanya.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
Larutan elektrolit yang memberikan gejala berupa lampu menyala dan membentuk gelembung gas disebut elektrolit kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur. Adapun elektrolit yang tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas termasuk elektrolit lemah. Contohnya yaitu larutan amonia, larutan cuka,dan.

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Pengertian larutan elektrolit. Larutan elektrolit adalah larutan yang dapat mengantarkan listrik sehingga dapat menyalakan lampu atau menimbulkan gelembung gas di sekitar elektrodanya. Baca juga: Pengertian Larutan, Suspensi, dan Koloid. Larutan elektrolit mengandung partikel-partikel yang bermuatan, yakni kation dan anion.
BLOG belajar teknik industri by Eingingeng LARUTAN ELEKTROLIT
Elektrolit Dan Non Elektrolit - Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh. Elektrolit Dan Non Elektrolit - Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh : Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan diri dan masing-masing zat penyusunnya tidak dapat diedakan lagi secara fisik.