
Power Point Materi Hidrolisis Garam
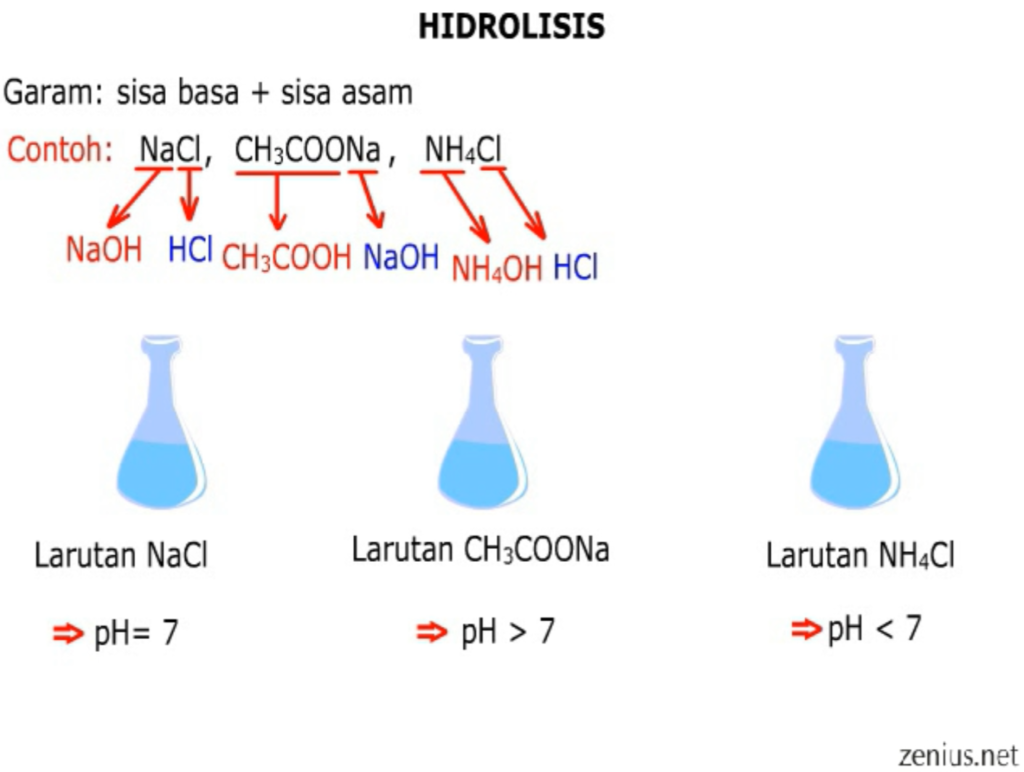
Oleh karena itu garam dapat terbentuk dari 4 reaksi hidrolisis kimia sebagai berikut: Garam yang berasal dari asam lemah dan basa kuat bersifat netral dan memiliki pH = 7, yang artinya tidak terjadi hidrolisis. Garam dari asam kuat dan basa lemah, di mana garam ini akan memiliki pH < 7 alias bersifat asam. Garam dari asam lemah dan basa kuat.

Hidrolisis Garam Kimia Kelas 11 • Part 5 Contoh Soal Perhitungan pH Larutan Garam (2) YouTube
Sifat asam atau basa larutan yang dihasilkan hidrolisis garam bergantung pada jenis asam basa yang membentuk garam tersebut. Baca juga: Hukum Kekekalan Energi: Pengertian, Rumus, dan Penerapannya. Misalnya garam yang terbentuk dari asam kuat dan basa kuat, garam yang terbentuk dari asam kuat dan basa lemah, garam yang terbentuk dari asam lemah.

Konsep Reaksi Hidrolisis Garam Materi Hidrolisis Garam Kimia SMA Kelas 11 YouTube
Oleh karena itu garam dapat terbentuk dari 4 reaksi kimia sebagai berikut: 1. Garam dari asam kuat dan basa kuat, dimana garam ini akan memiliki pH = tujuh alias bersifat netral, yang artinya tidak terjadi hidrolisis. 2. Garam dari asam kuat dan basa lemah, garam akan memiliki pH < tujuh alias bersifat asam. 3.

Hidrolisis Garam Soal dan Pembahasan KIMIA KELAS 11 YouTube
menghasilkan garam. Garam adalah senyawa elektrolit yang dihasilkan dari reaksi netralisasi antara asam dengan basa. KOMPETENSI DASAR: Menentukan jenis garam yang mengalami hidrolisis dalam air dan pH larutan garam tersebut. TUJUAN PEMBELAJARAN: 1. Menentukan ciri-ciri beberapa jenis garam yang dapat terhidrolisis dalam air melalui percobaan 2.

LENGKAP UNTUK PEMULA ‼️ HIDROLISIS GARAM PART2 ‼️ CARA MENULISKAN REAKSI HIDROLISIS YouTube
Hidrolisis garam merupakan salah satu materi yang harus dipelajari oleh siswa kelas XI. Kurikulum 2006 menuntut siswa SMA/MA kelas XI untuk dapat menentukan jenis garam yang mengalami hidrolisis dalam air dan pH larutan garam tersebut. Hal ini tertuang dalam Standar Kompetesi (SK) no. 4 dan Kompetensi Dasar (KD) no. 4.4.
Hidrolisis Garam Materi Kimia Kelas 11
Laporan Kimia - hidrolisis. Reaksi reaksi dalam larutan asam dan basa. Hidrolisis garam. hidrolisis Garam. Laporan Praktikum Logam alkali. Larutan Asam,Larutan Basa, dan Larutan Neutral. Tugas kimia ( 26-11-2013 ) Laporan hasil percobaan laju reaksi. Laporan praktikum kimia uji Elektrolit.

Hidrolisis Garam Kimia Kelas 11 YouTube
Berdasarkan pengalaman guru, materi hidrolisis garam sulit dipahami oleh siswa dan sering terjadi miskonsepsi (Tonih, 2004). Sebagai contoh, dalam menentukan pH larutan garam banyak yang beranggapan bahwa sifat larutan garam adalah netral dan pH garam selalu 7 karena berasal dari hasil reaksi

Hidrolisis Garam Soal Jawab 1 Reaksi hidrolisis, konstanta hidrolisis, derajat hidrolisi dan pH
Manfaat Reaksi Hidrolisis. Reaksi hidrolisis ini banyak diterapkan dalam kehidupan sehari hari, berikut ini beberapa contoh manfaat dari hidrolisis dalam kehidupan: Hidrolisis berperan dalam pembentukan garam dapur (NaCl) yang merupakan reaksi antara basa kuat dengan asam kuat. Garam dapur ini banyak digunakan sebagai bahan penyedap dalam makanan.

Teori Hidrolisis Garam 1 YouTube
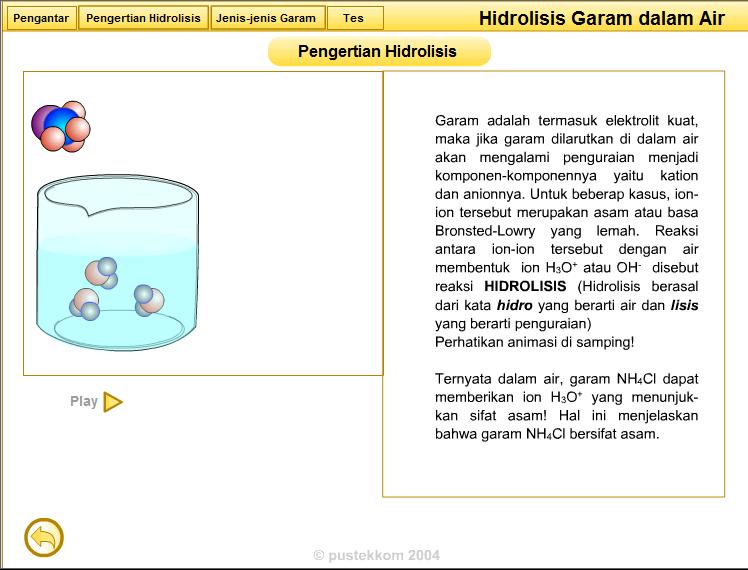
C. Dasar Teori : Hidrolisis garam adalah reaksi peruraian suatu garam dalam air. Reaksi hidrolisis terjadi antara ion - ion garam (dalam air) dengan air sehingga ion ( + ) dan ion ( - ) dari garam bereaksi dengan air membentuk asam dan basa asalnya. Hidrolisis garam pada dasranya merupakan reaksi asam basa Bronsted-Lowry.

Contoh soal hidrolisis garam 1 YouTube
Manfaat Hidrolisis Garam dalam Kehidupan. Proses hidrolisis garam memiliki banyak manfaat dalam kehidupan sehari-hari. Contohnya adalah: Garam amonium nitral (NH 4 NO 3) yang merupakan campuran dari basa lemah dan asam kuat. Sehingga garam ini bersifat asam. Amonium nitrat biasanya digunakan untuk alat kompres dingin.

PERCOBAAN HIDROLISIS GARAM; MENENTUKAN SIFAT DAN pH LARUTAN GARAM YouTube
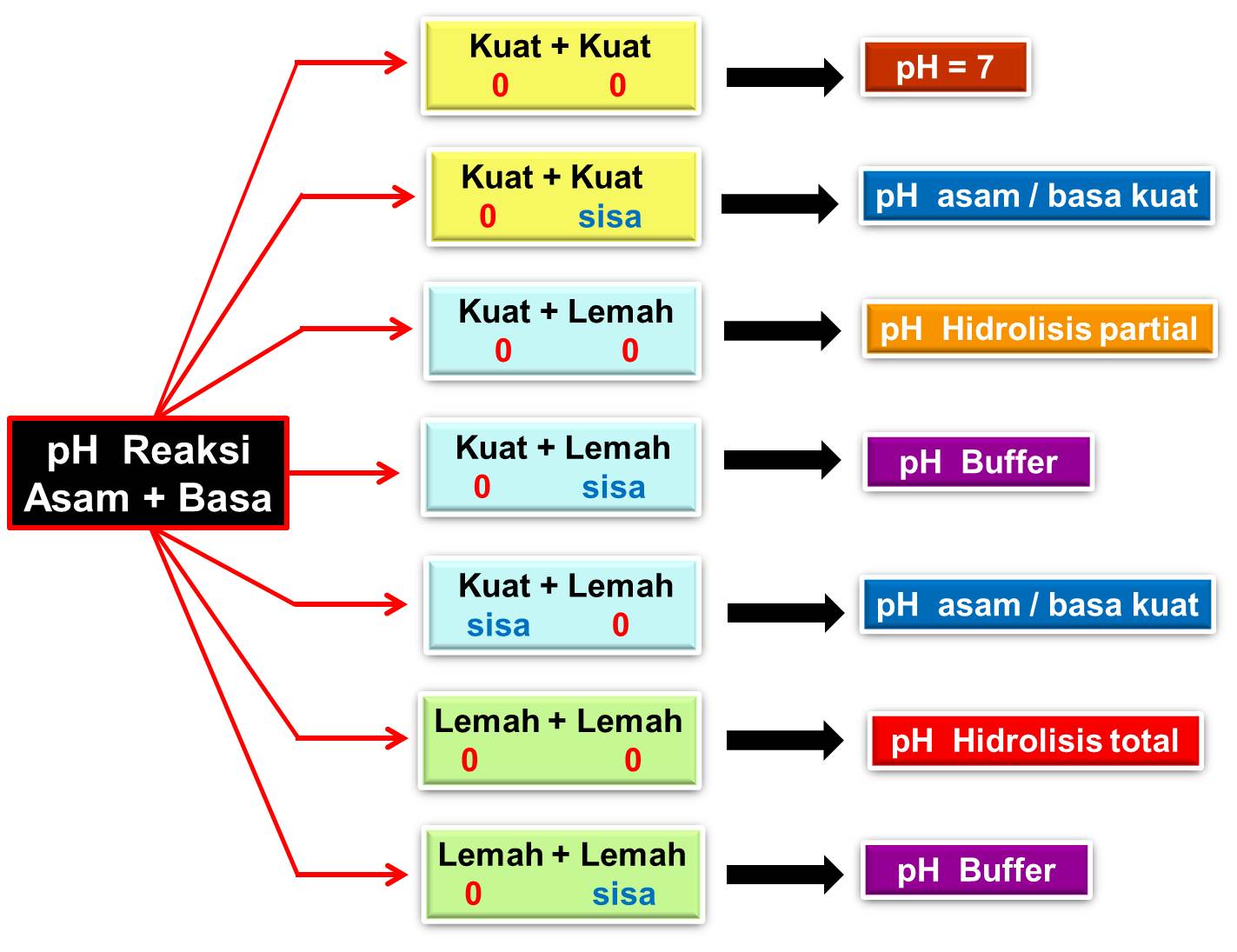
Sifat Hidrolisis Garam. Hidrolisis garam merupakan reaksi reversible penguraian garam oleh air. Reaksi ini bekerja pada salah satu ion-ion garam (kation atau anion) dengan air sehingga membentuk larutan bersifat asam atau basa. Sifat asam atau basa yang dihasilkan pun bergantung pada jenis asam basa yang membentuk garam tersebut.
Peta Konsep Hidrolisis Garam IMAGESEE
II. DASAR TEORI Hidrolisis garam adalah reaksi peruraian suatu garam dalam air. Reaksi hidrolisis terjadi antara ion - ion garam (dalam air) dengan air sehingga ion ( + ) dan ion ( - ) dari garam bereaksi dengan air membentuk asam dan basa asalnya. Hidrolisis garam pada dasranya merupakan reaksi asam basa Bronsted-Lowry.
Konsep Reaksi Hidrolisis Garam Materi Hidrolisis Garam Kimia Sma Riset
Pembahasan Hidrolisis. ari sutono. 1. Jawaban: A. karena merupakan elektrolit kuat sehingga tidak terhidrolisis dalam air 2. Jawaban : E, karena garam tersebut terbentuk dari asam lemah dan basa lemah 3. Jawaban : E, garam terhidrolisis sebagian jika terbentuk dari lemah dan kuat, bersifat basa, maka yang kuat harus basa. 4.

Hidrolisis Garam Contoh soal hidrolisis 1 Kimia Kelas 11 YouTube
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.

MATERI HIDROLISIS GARAM.ppt
Konsep hidrolisis garam tergolong konsep yang sulit bagi siswa menengah atas (Orwat, Bernard, dan Mikuli, 2017). Ada banyak konsep abstrak dan saling berhubungan dengan konsep sebelumnya pada konsep hidrolisis garam. Konsep asam basa merupakan dasar untuk mempelajari konsep hidrolisis garam. Hal ini terlihat pada

Soal Hidrolisis Garam Dan Penyelesaiannya
Modul hidrolisis garam ini berisikan kesetimbangan ion dalam larutan garam dan penghitungan pH-nya. Di dalam air, garam akan terionisasi dan apabila ion-ion yang terbentuk itu bereaksi dengan air maka terjadilah reaksi hidrolisis. Ion yang berasal dari garam dianggap bereaksi dengan air jika ion tersebut dalam reaksinya menghasilkan asam lemah atau basa lemah.