
Teori Asam Basa
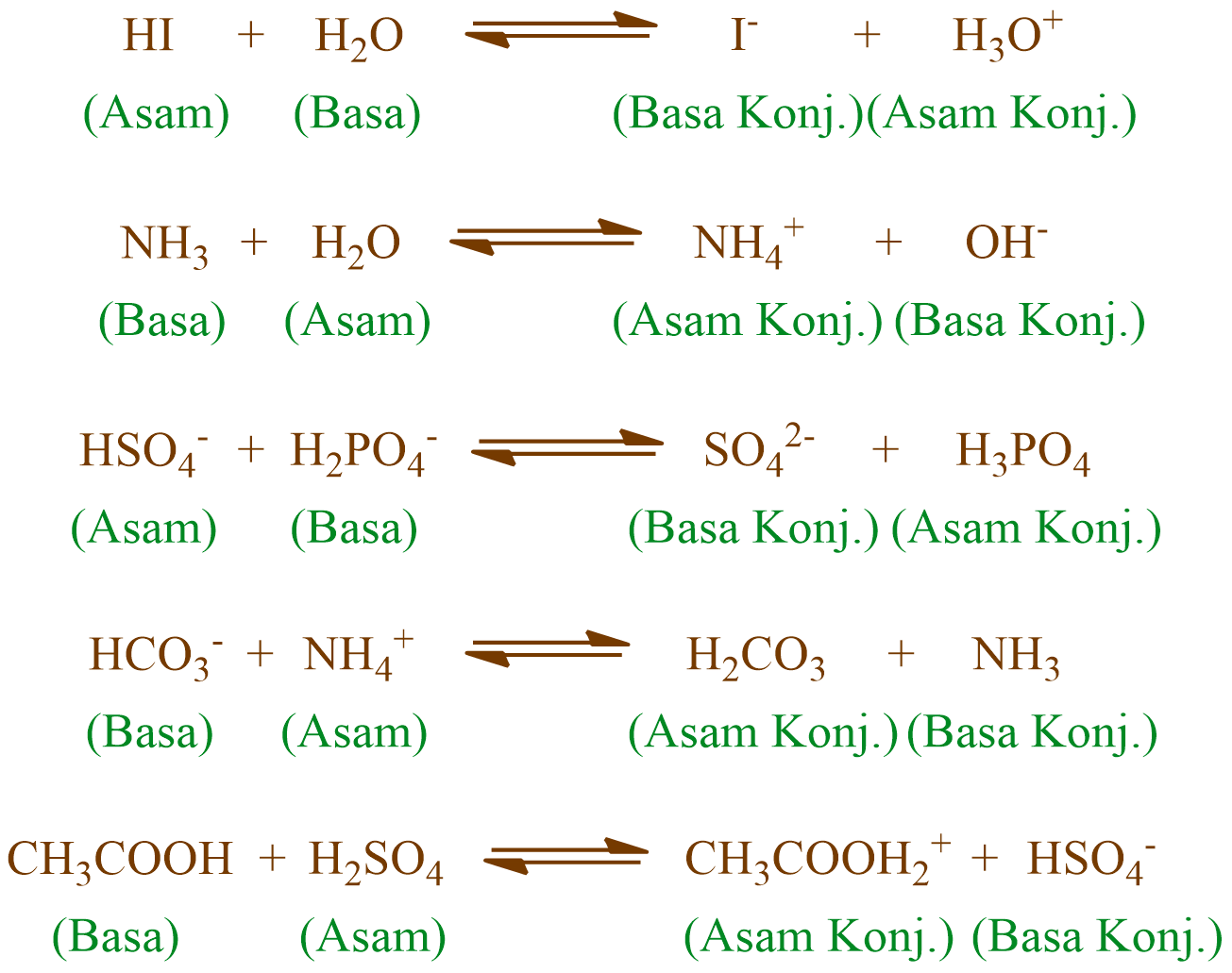
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

24+ Contoh Soal Asam Basa Arrhenius Cherie Potts
Pada gambar di sebelah kanan, satu molekul H2O bertindak sebagai basa dan mendapatkan H + menjadi H3O+ sementara lainnya bertindak selaku asam dan kehilangan H+ dan menjadi OH −. Contoh lain dapat dilihat pada aluminium hidroksida Al (OH)3. Asam Basa pH - Rumus Kimia - Penjelasan, Contoh Soal dan Jawaban.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Asam Basa Arrhenius. Teori satu ini dikemukakan di tahun 1884 oleh Svante August Arrhenius. Definisi asam basa menurut Arrhenius yaitu: Asam merupakan senyawa yang apabila dilarutkan di dalam air akan melepaskan ion H +. Basa merupakan senyawa yang apabila dilarutkan di dalam air akan melepaskan ion OH −.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Konsep Asam Basa dalam bentuk pdf pada link dibawah ini: Modul Konsep Asam Basa; Kumpulan Soal Mudah, Sedang & Sukar; Asam dan Basa. Dari beberapa ratus tahun yang lalu, ahli-ahli kimia telah menemukan dan mendefinisikan beragam senyawa yang disebut asam dan basa.
Teori Asam Basa Lewis KIMIA OKE PINTAR
Video Contoh Soal Asam dan Basa Kelas 11. 02:15. Jika diketahui nilai Ka beberapa asam berikut. Asam HF HB. Sifat Koligatif Larutan. pH Asam Kuat, Basa Kuat, Asam Lemah, dan Basa Lemah. Asam dan Basa. Sifat Koligatif Larutan. Kimia Fisik dan Analisis.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Contoh reaksi asam basa Lewis adalah reaksi antara Na 2 O dan SO 3. Na 2 O + SO 3 → Na 2 SO 4. Baca Juga: Pengertian Larutan dan Klasifikasinya - Kimia Kelas 11. Contoh Soal dan Pembahasan Reaksi Asam Basa. Untuk menguji sejauh mana pemahaman mengenai materi reaksi asam basa, gue ada beberapa contoh soal dan pembahasan yang bisa dijadikan.

XI.6.q. Teori Asam Basa Lewis (Teori) YouTube
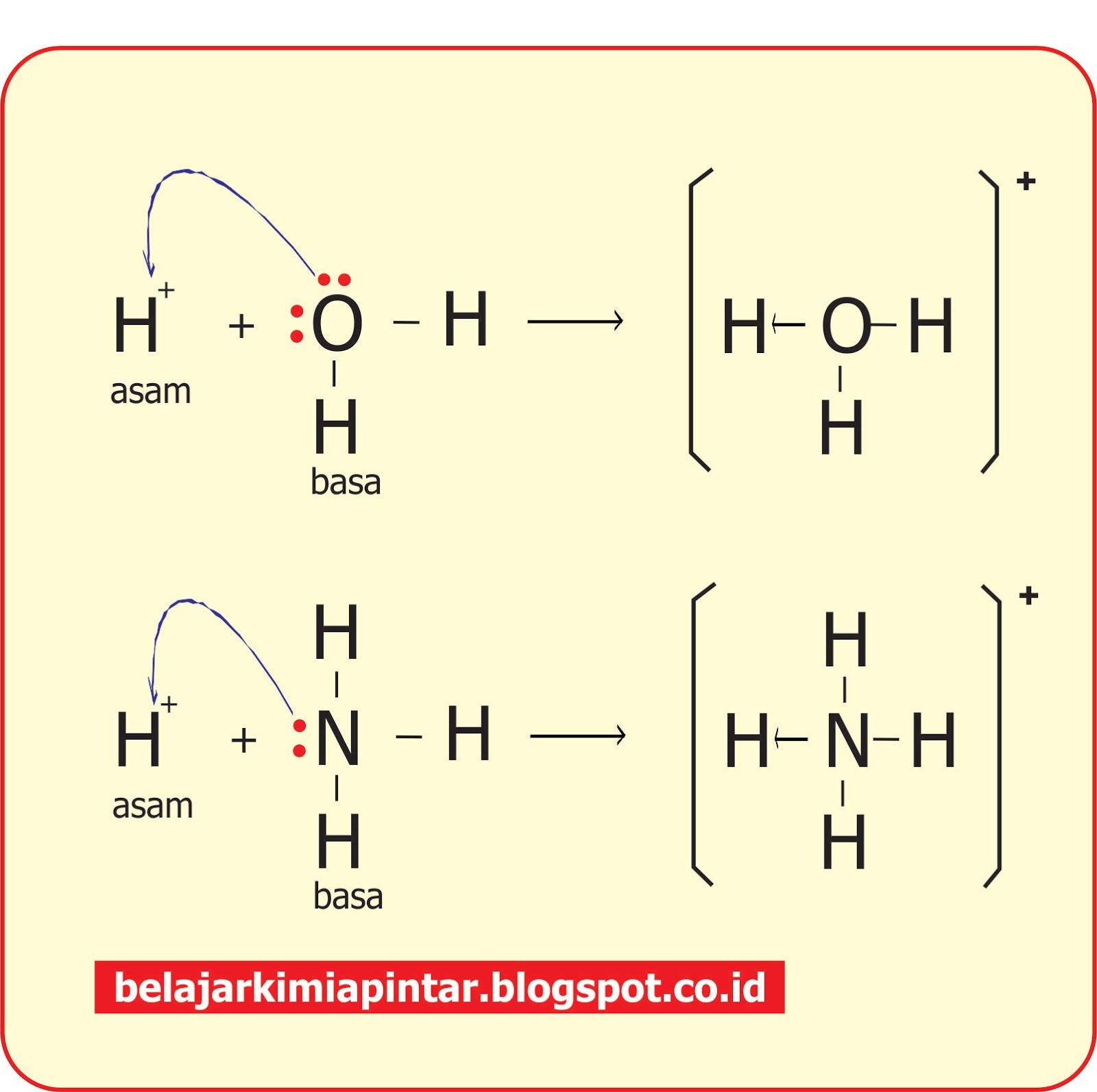
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Berikut adalah contoh soal asam basa dalam bentuk pilihan ganda. Contoh soal asam basa ini telah kami lengkapi dengan kunci jawabannya. Selain itu, kamu juga bisa mendownload contoh soal asam basa ini lohh. Sehingga kamu akan lebih mudah mempelajari contoh soal asam basa ini. Soal No. 1 Menurut Arrhenius H2O bersifat netral karena.. . .

10 Contoh Soal Titrasi Asam Basa Lengkap Dengan Kunci Jawaban dan Cara Mengerjakannya yang
Video ini berisi tentang bagaimana cara menentukan Asam dan Basa berdasarkan teori asam basa Lewis. Ini adalah materi kimia kelas 11 IPA semester 2. Mohon ba.

latihan soal UN Asam basa brondsted Lowry kimia SMA YouTube
Asam Basa: Teori, Contoh, dan Sifat Asam Basa. Desember 3, 2021 oleh Ahmad Nurokhim. Istilah "asam" sendiri berasal dari bahasa latin acidus yang berarti cuka. Di sisi lain, istilah basa berasal dari bahasa Arab alkali yang berarti abu. Suatu larutan dapat diketahui apakah sifatnya asam atau basa saat berada dalam bentuk larutan.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Contoh Soal. 1. Tentukan manakah asam dan basa didalam reaksi asam basa berikut dengan cara memberikan alasan berdasarkan teori asam basa Brønsted-Lowry, Arrhenius, atau Lewis. Ni 2+ (aq) + 4CN - (aq) ⇌ [Ni(CN) 4] 2-(aq) Jawab: Teori Arrhenius serta teori Brønsted-Lowry tidak bisa menjelaskan reaksi diatas.

Contoh Soal Dan Pembahasan Titrasi Asam Basa Jurnal Ilmiah Farmasi Riset
Soal 7: Berikan contoh asam kuat dan basa kuat. Pembahasan: Contoh asam kuat termasuk asam klorida (HCl), asam nitrat (HNO₃), dan asam sulfat (H₂SO₄). Contoh basa kuat termasuk natrium hidroksida (NaOH) dan kalium hidroksida (KOH). Soal 8: Jelaskan apa itu hidrolisis garam dan bagaimana hal tersebut berkaitan dengan asam-basa. Pembahasan: Hidrolisis garam adalah reaksi garam dengan air.

31++ Contoh Soal Tentang Asam Basa Konjugasi Contoh Soal Terbaru
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Soal Pembahasan Teori Asam Basa Nomor 6 rukim.id. Diketahui persamaan reaksi asam-basa Bronsted-Lowry berikut: H 2 PO 4- + H 2 O ⇌ H 3 PO 4 + OH-. H 2 PO 4- + H 2 O ⇌ PO 43- + H 3 O +. Berdasarkan teori asam-basa Bronsted-Lowry, sifat spesi H 2 O dalam kedua reaksi tersebut adalah.. A. Reaksi 1: bersifat asam karena.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
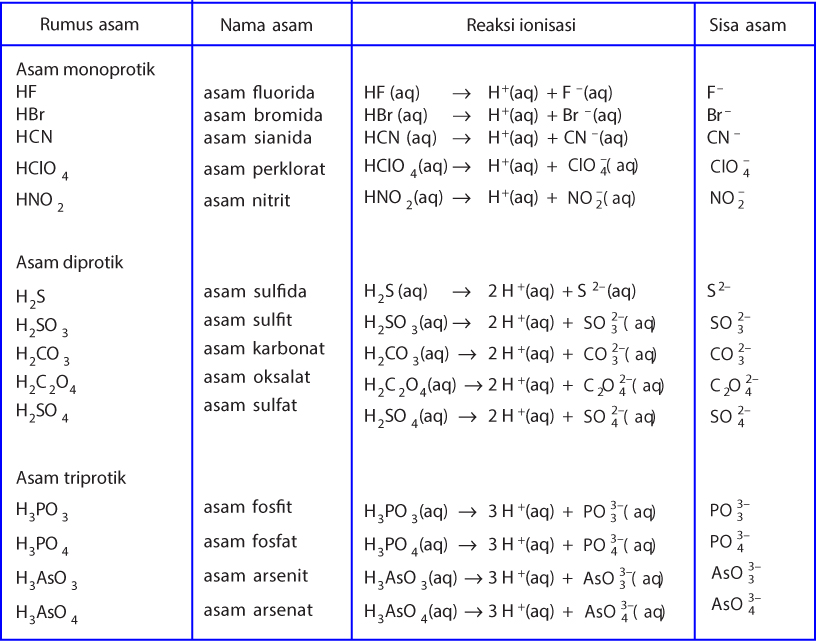
Suatu asam atau basa disebut kuat jika terurai sempurna (atau mendekati sempurna) di dalam air, kekuatan ini disebut juga dengan kekuatan ionisasi. Contoh asam kuat adalah: HCl, HBr, H 2 SO 4, HNO 3, HI, HIO4, dan HbrO4.Untuk basa kuat contohnya adalah: NAOH (natrium hidroksida), KOH (kalium hidroksida), Ba(OH) 2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan K, dan.

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
1 - 15 Contoh Soal Asam Basa dan Jawaban. 1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . . a. Meningkatkan [H +] bila dimasukkan kedalam H 2 O. b. Menurunkan [H +] bila dimaasukkan kedalam H 2 O. d. Menerima 1 H + dari pasangan reaksinya.