
Ikatan Kovalen KoordinasiKimia Kelas X PestaUli Marbun YouTube
Contoh ikatan kovalen jenis ini adalah pembentukan senyawa HCl dan CH4. a. Pembentukan HCl. Konfigurasi elektron 1H : 1s1 sehingga elektron valensinya = 1. Untuk mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet) diperlukan 1 elektron. Konfiguarsi elektron 17Cl adalah 1s2 2s2 2p6 3s2 3p5 sehingga CI dan mempunyai elektron valensi = 7.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi Siswapedia
Ikatan kovalen koordinasi. Ikatan kovalen koordinasi, [1] juga disebut sebagai ikatan datif, [2] ikatan dipolar, [3] atau ikatan koordinat [4] adalah suatu jenis ikatan kovalen dua pusat, dua elektron yang kedua elektron tersebut berasal dari atom yang sama. Pengikatan ion logam pada ligan melibatkan jenis interaksi ini. [5]

Cara mudah menentukan Ikatan Kovalen Koordinasi YouTube
Kalau ikatan kovalen nonpolar, pasangan elektron ikatannya akan sama kuat ke semua atom, di mana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak. Nah, itu dia jenis-jenis ikatan kovalen.

Ikatan kovalen koordinat soal gambar ikatan kovalen koordinat kimia SMA YouTube
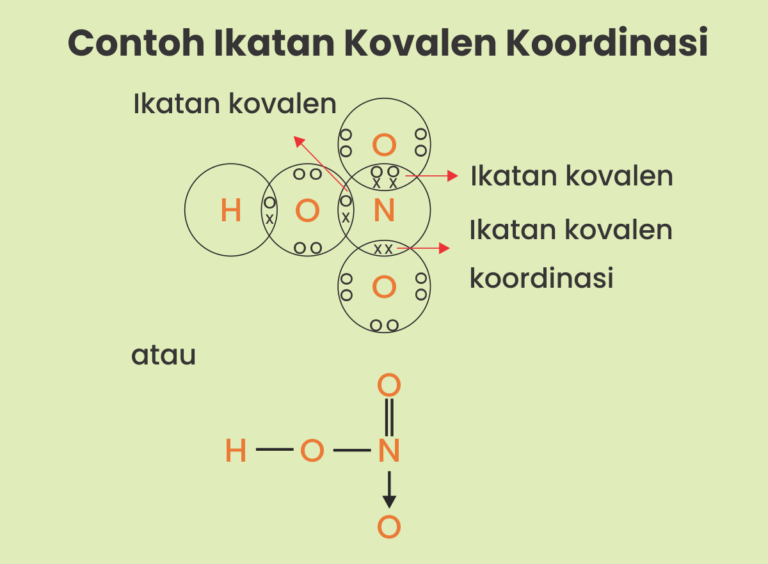
2. Ikatan Kovalen Koordinasi. Ikatan kovalen koordinasi adalah ikatan yang terjadi karena penggunaan pasangan elektron bersama, namun pasangan elektron tersebut hanya berasal dari salah satu atom yang berikatan. Contoh Ikatan Kovalen Koordinasi. Ikatan dalam molekul SO 2. Konfigurasi elektron S : 2 8 6, elektron valensi = 6

Ikatan Kovalen Koordinasi KIMIA KELAS 10 YouTube
Ikatan Kovalen Koordinasi. Ikatan kovalen koordinasi (ikatan dativ) adalah ikatan kovalen di mana salah satu atomnya mendonasikan pasangan elektron yang dimilikinya. Pada ikatan kovalen koordinasi, pasangan elektron ikatannya hanya berasal dari satu atom, bukan dari kontribusi bersama kedua atom yang berikatan. Contoh: Ikatan logam: "lautan.

Soal Ikatan Kovalen (Tunggal) dan Pembahasannya YouTube
Contoh ikatan kovalen koordinasi Contoh soal ikatan kimia pilihan ganda. Contoh soal 1. Atom X memiliki nomor atom 20 dan atom Y memiliki nomor atom 9, senyawa yang terbentuk antara X dan Y adalah. A. X 2 Y B. XY 2 C. X 2 Y 3 D. XY E. X 2 Y 2. Pembahasan. Konfigurasi elektron X = 2, 8, 8, 2 Konfigurasi elektron Y = 2, 7

Materi Kimia kelas 10 Ikatan Kovalen Koordinasi dan Penyimpangan Kaidah Oktet _ Struktur SO3
Beberapa senyawa kovalen mempunyai sifat ion karena adanya perbedaan elektronegativitas. 3. Perbedaan elektronegativitas tidak mempengaruhi kekuatan ikatan kovalen. 4. Perbedaan elektronegativitas mempengaruhi kekuatan ikatan kovalen, namun bukan faktor yang paling menentukan. 5. Tidak ada pilihan yang tepat.

Bagaimana Ikatan Kovalen Koordinasi SO3 (Sulfur Trioksida) Terbentuk ? YouTube
Ikatan kovalen koordinasi disebut juga sebagai ikatan datif, ikatan dipolar, atau ikatan koordinat. Ikatan kovalen koordinasi merupakan jenis ikatan kovalen yang dapat dibedakan dari sumber elektron dengan penggunaannya bersamaan. Ikatan ini bisa terjadi, jika terdapat satu atom yang menyerahkan pasangan elektron, sehingga atom dari pasangannya.

Kimia Kelas X Ikatan Kovalen Koordinasi. YouTube
Ikatan kovalen koordinasi terjadi ketika elektron-elektron yang digunakan untuk berikatan berasal dari salah satu unsur yang berikatan. Contoh ikatan kovalen koordinasi terdapat pada ion-ion dan senyawa-senyawa berikut. NH4+, HNO3, SO3, H2SO4, H3O+, H3NBF3, POCl3, HClO4, SO2Br2, N2O. 1. Ikatan Kovalen Koordinasi NH4+ 2. Ikatan Kovalen Koordinasi HNO3 3.

Ikatan Kovalen Koordinasi Senyawasenyawa kovalen koordinasi Lengkap YouTube
Jadi, dalam molekul H 2 SO 4 terdapat empat ikatan kovalen tunggal dan dua ikatan kovalen koordinasi. (Chemistry 1A, Nana Sutresna, Facil, 2010, Hal: 73) 31 - 45 Contoh Soal Ikatan Kimia dan Kunci Jawaban. 31. Diantara senyawa berikut yang bukan molekul kovalen polar adalah? a. HCl. b. NACl. c. NH 3. d. H 2 0. e. PCl 3. Jawaban : B

Contoh Soal Ikatan Kovalen Koordinasi Dan Pembahasannya Gif Auto My XXX Hot Girl
Contoh ikatan kovalen koordinasi. 1. Senyawa SO3. Atom 16S memiliki konfigurasi elektron 2 8 6. Jadi, atom ini memiliki enam elektron valensi. Atom 8O memiliki konfigurasi elektron 2 6. Untuk membentuk senyawa SO3 yang memenuhi kaidah oktet, sepasang elektron dari atom S akan berikatan dengan sepasang elektron dari atom O sehingga membentuk.

Menentukan Ikatan Kovalen Koordinasi YouTube
Video penjelasan ikatan kovalen koordinasi, proses terjadinya ikatan dengan contoh ikatan kovalen koordinasi yaitu di dalam ion amonium dan dalam senyawa SO.

Ikatan Kovalen Koordinasi, Kenali Pengertian dan Contohnya
Contoh Soal Ikatan Kovalen Koordinasi dan Pembahasannya. Gambarkan struktur lewis dari senyawa SO 3 dan tunjukka bagian mana yang merupakan ikatan kovalen koordinasi! Penyelesaian. Pada senyawa SO 3, atom S mengikat 3 atom O. Konfigurasi elektron dari dua unsur penyusun senyawa tersebut adalah sebagai berikut:

IKATAN KOVALEN KOORDINASI KIMIA OKE PINTAR
Ikatan kovalen koordinasi, juga disebut sebagai ikatan datif, ikatan dipolar, atau ikatan koordinat adalah suatu jenis ikatan kovalen dua pusat, dua elektron yang kedua elektron tersebut berasal dari atom yang sama. Pengikatan ion logam pada ligan melibatkan jenis interaksi ini. Jenis pengikatan ini menjadi hal yang penting pada teori asam-basa Lewis.
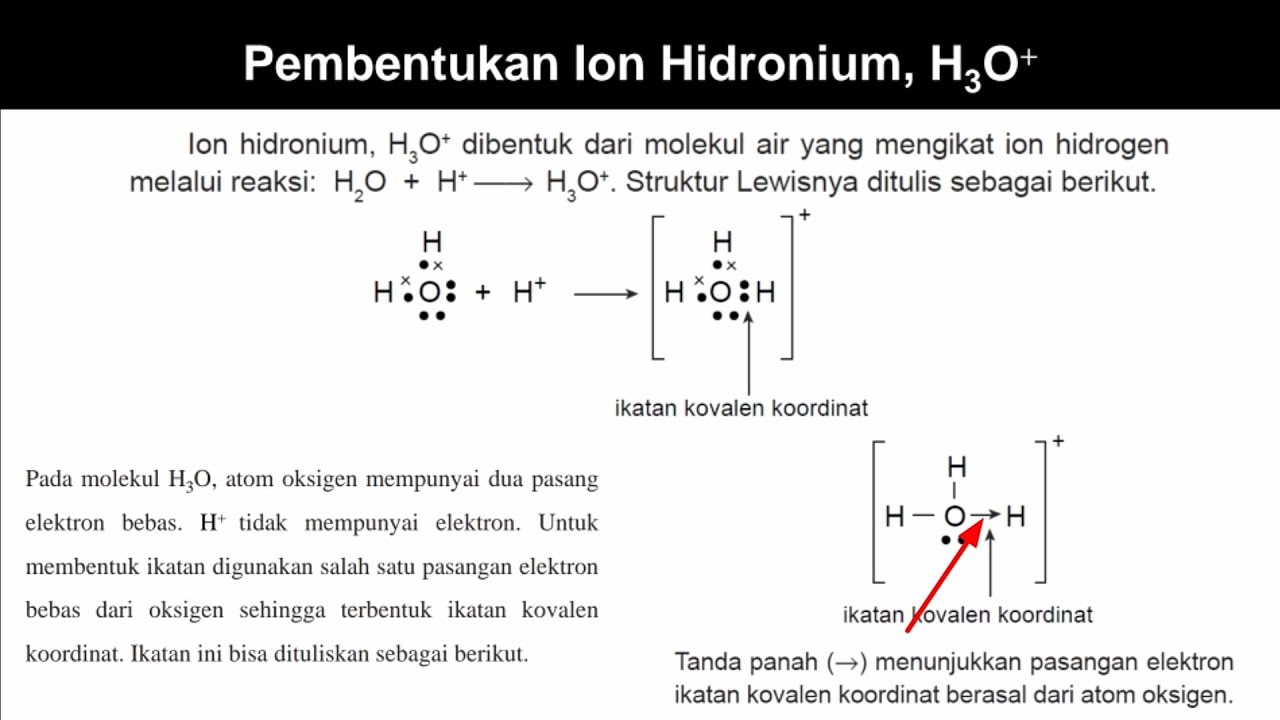
Bagaimana Ikatan Kovalen Koordinasi H3O+ (Hidronium) Terbentuk ? YouTube
Video ini bertujuan untuk menjelaskan ikatan kovalen koordinasi yang terjadi pada SO2 atau sulfur dioksida dengan berbasis tiga level multi representasi kimi.

Contoh Soal Ikatan Kovalen Koordinasi Kunci Ujian
Ikatan kovalen adalah ikatan yang terbentuk dari pemakaian bersama pasangan elektron oleh dua atau lebih atom non logam. Ikatan kovalen ini dibedakan berdasarkan jumlah pasangan elektron dan kepolarannya. Agar lebih jelas, artikel ini akan membahas seputaran ikatan kovalen, mulai dari pengertian, jenis, sifat, hingga cara menggambar ikatan ini.