
Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
Kelemahan dari teori Brønsted-Lowry yaitu teori Brønsted-Lowry tidak dapat menjelaskan reaksi asam-basa yang tidak melibatkan transfer proton (H +).. Namun, spesi yang berperan sebagai asam Lewis tidak selalu menyediakan orbitasl kosong. Contoh asam lewis yaitu: H + B 2 H 6; BF 3; AlF 3; Fe 2+ Cu 2+ Zn 2+ 2. Contoh Basa Lewis.

XI.6.q. Teori Asam Basa Lewis (Teori) YouTube
Konsepkan mudah belajar teori asam basa lewis . dimana asam adalah penerima pasangan elektron sedangkan basa adalah pemberi pasangan elektron. Kimia SMA
PPT teori asam basa PowerPoint Presentation, free download ID78826
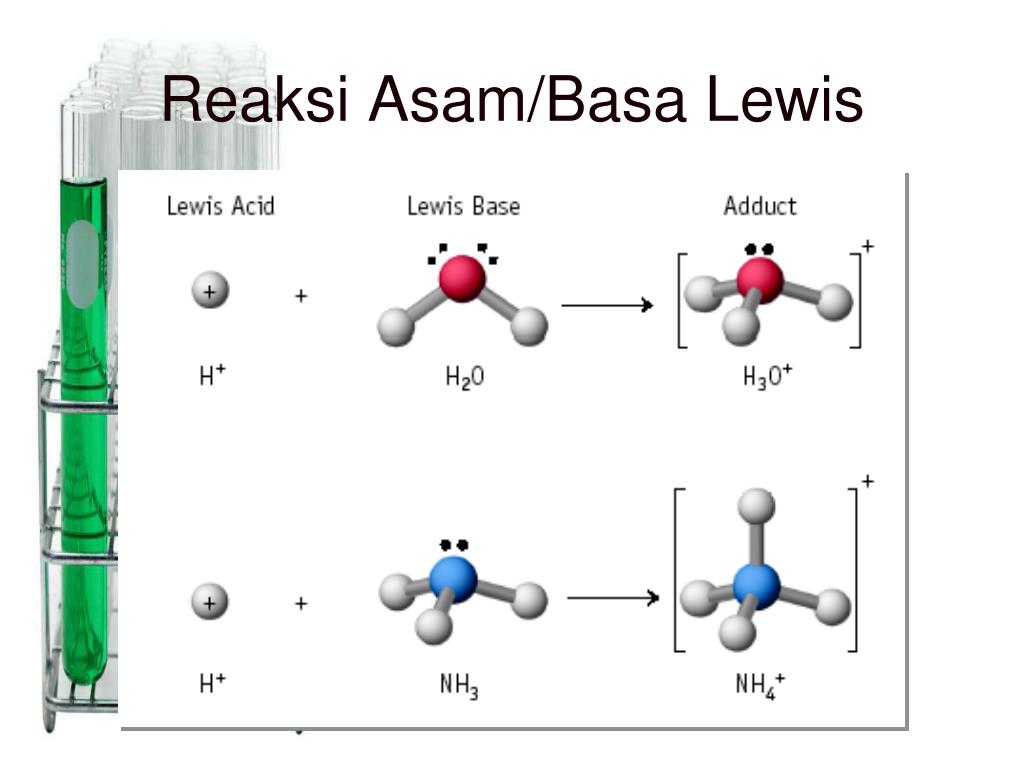
Oleh karena itu, pada tahun 1932, Gilbert N. Lewis, seorang kimiawan asal Amerika Serikat mengemukakan teori asam basa yang lebih luas dibandingkan dua teori sebelumnya yang kemudian dikenal dengan teori asam basa Lewis. Menurut Lewis, asam basa adalah reaksi yang berkaitan dengan proses serah terima (transfer) elektron.
tuliskan pasangan asam basa lewis dari reaksi beri...
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).

Contoh Soal Asam Basa Lewis Asam Basa Pengertian Teori Reaksi Indikatornya Lengkap Contoh
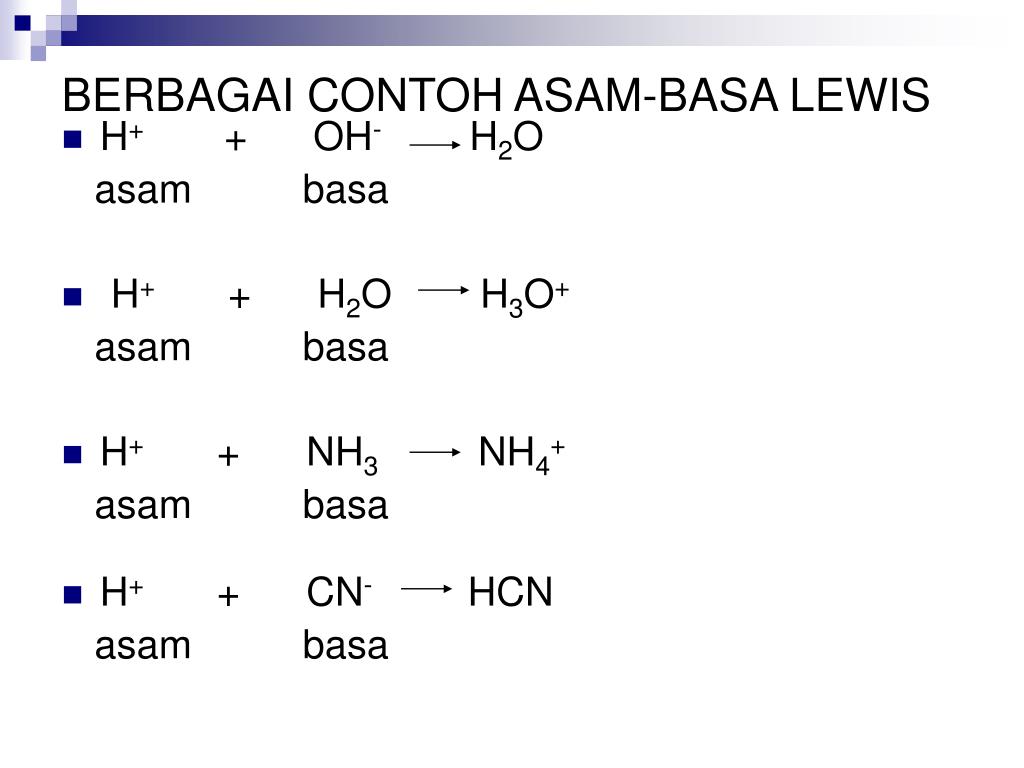
Kelebihan teori asam basa Lewis yaitu dapat menjelaskan reaksi-reaksi asam-basa lain dalam fase padat, gas, dan medium pelarut selain air yang tidak melibatkan transfer proton.. 3−, [Al(H2O)6]3+, dan [Cu(NH3)4]2+, dan sebagian reaksi dalam kimia organik. Contoh Soal dan Pembahasan. Tentukan manakah asam dan basa dalam reaksi asam-basa.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Kekurangan Teori Asam Basa Lewis. Walaupun memiliki beberapa kelebihan, teori asam basa Lewis juga mempunyai kekurangan yang perlu diketahui. Teori asam dan basa Lewis ini cukup sulit untuk menggambarkan reaksi asam-basa, seperti reaksi antara ion Fe3+ dan ion CN-. Sebab keduanya tidak melibatkan ion H+ atau ion OH-.

Peran Sentral Konsep AsamBasa dalam Reaksi Kimia Organik
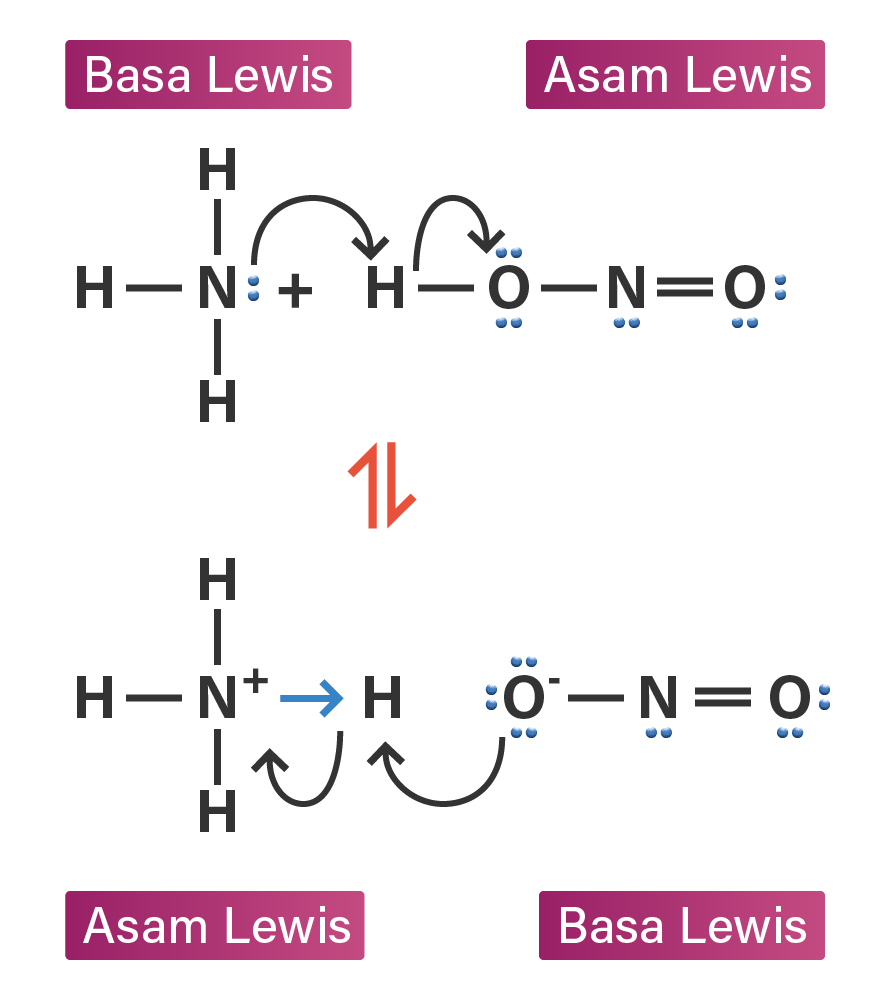
Berdasarkan contoh reaksi asam basa ini, Lewis menyatakan bahwa: Contoh lainnya adalah reaksi antara Na 2O dan SO 3 yang menghasilkan Na 2SO 4 tanpa terbentuk air seperti reaksi di bawah ini: Basa lewis dari reaksi di atas adalah ion oksida sedangkan sulfur trioksida adalah asam Lewis. Reaksi di atas menggambarkan keterbatasan teori

Teori Asam Basa
Kelebihan teori asam basa Lewis adalah: Dapat mengklasifikasikan asam dan basa dalam berbagai pelarut (selain air) dan juga tanpa pelarut. Dapat menjelaskan reaksi asam-basa tanpa transfer proton. Dapat menjelaskan sifat asam asa zat yang memiliki elektron bebas. Memperluas definisi asam basa, seperti pada pembuatan ion kompleks.

studying chemistry belajar kimia Teori Asam Basa Lewis
Kelebihan asam basa Lewis. 1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam, basa dalam pelarut lain maupun tidak mempunyai pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas atau yang dapat menerima pasangan elektron bebas.
Teori Asam Basa Lewis KIMIA OKE PINTAR
Contoh reaksi asam basa Lewis adalah reaksi antara Na 2 O dan SO 3. Na 2 O + SO 3 → Na 2 SO 4. Baca Juga: Pengertian Larutan dan Klasifikasinya - Kimia Kelas 11. Contoh Soal dan Pembahasan Reaksi Asam Basa. Untuk menguji sejauh mana pemahaman mengenai materi reaksi asam basa, gue ada beberapa contoh soal dan pembahasan yang bisa dijadikan.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID4714427
Tidak banyak contoh reaksi asam-basa Lewis pada buku kimia SMA. Tulisan ini memberikan tambahan agar siswa semakin paham tentang pengertian asam-basa Lewis beserta reaksi dan prosesnya. Bahasannya meliputi penggolongan manakah spesi yang berperan sebagai asam Lewis dan mana yang berperan sebagai basa Lewis, serta mekanismenya. Bahasan contoh di.
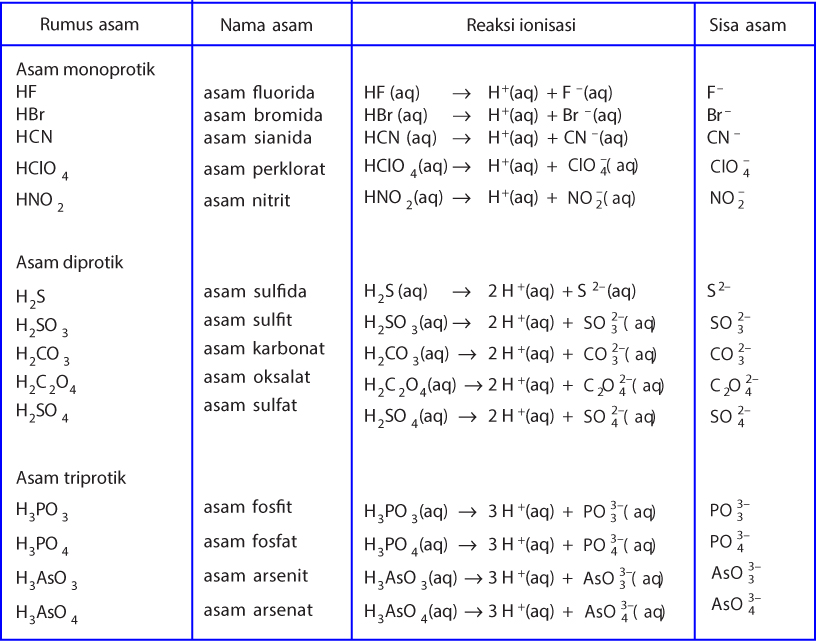
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

27+ Contoh Soal Asam Basa Lewis Ike Hodge
Sedangkan basa menurut Newton Lewis merupakan zat yang mampu memberikan pasangan pada electron. Dalam pandangan teori asam basa Lewis, basa memiliki pasangan yang elektronnya bebas, contohnya adalah seperti NH3, Cl-, maupuan ROH. Lebih lanjut, Lewis berpandangan bahwa reaksi dari asam dan basa adalah reaksi dari serah terima pasangan elektron.
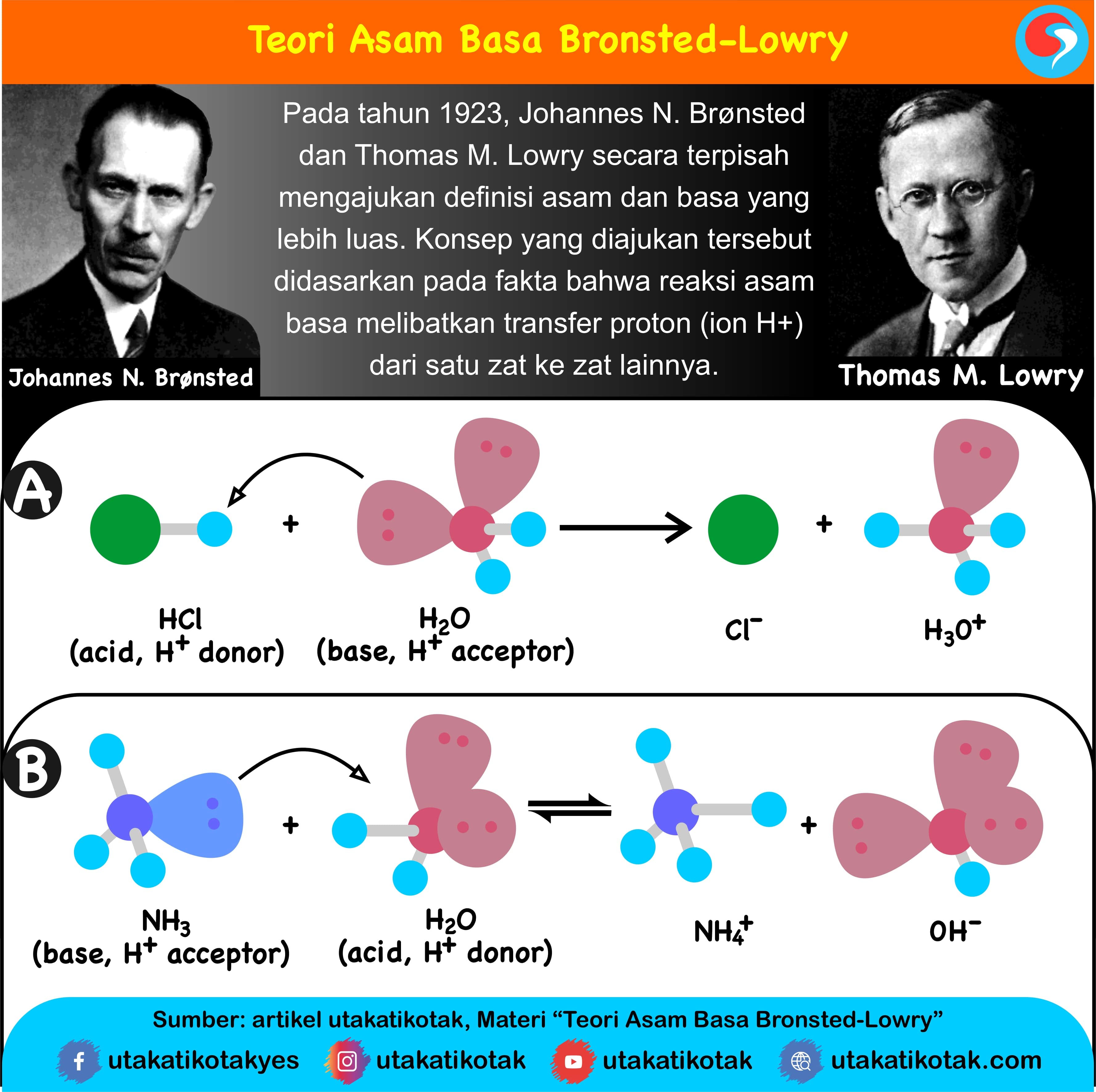
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
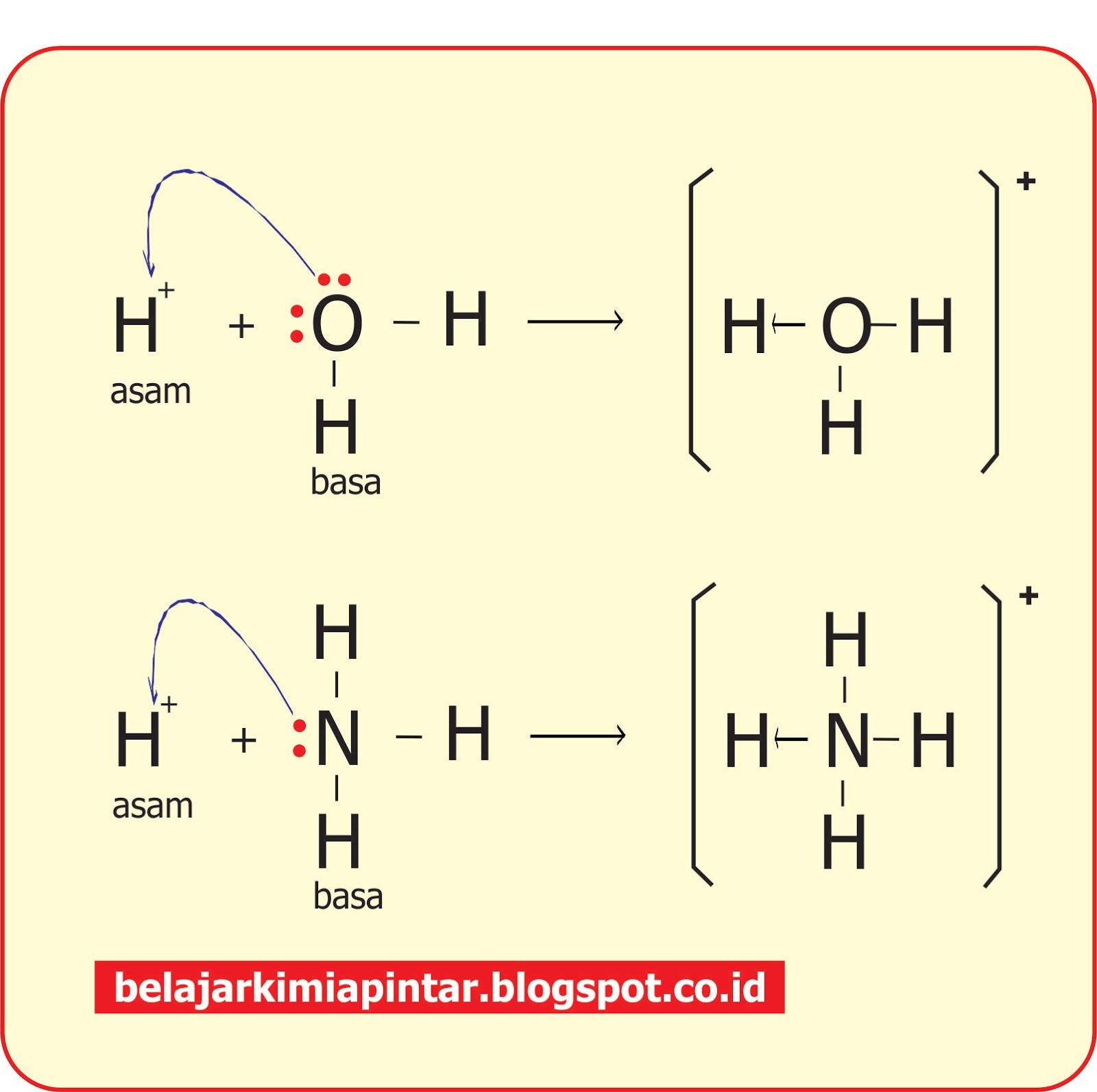
Contoh Teori Asam dan Basa Menurut Lewis pada Gambar diatas telah menunjukan bahwa Ion H+ (Proton) ialah Asam Lewis karena mampu menerima Pasangan Elektron, sedang NH3 merupakan Basa Lewis.. Newton Lewis lebih luas dan lengkap jika sepanjang yang dibahas didalamnya ialah Senyawa tanpa Proton, namun jika Reaksi Asam Basa yang melibatkan.

Konsep Mudah Belajar Teori Asam Basa LewisKimia SMA YouTube
Contoh reaksi antara asam lemah dan basa kuat adalah larutan CH 3 COOH (asam lemah) dan larutan NaOH (basa kuat) menghasilkan CH 3 COOHNa dan H 2 O. CH 3 COOH (aq) + NaOH (aq) → CH 3 COOHNa (aq) + H 2 O (l) Dari reaksi ini, dapat menghasilkan : Jika dalam reaksi ini zat yang tersisa adalah asam, maka akan terbentuk larutan bufer asam (pH < 7).

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Contoh Soal. 1. Tentukan manakah asam dan basa didalam reaksi asam basa berikut dengan cara memberikan alasan berdasarkan teori asam basa Brønsted-Lowry, Arrhenius, atau Lewis. Ni 2+ (aq) + 4CN - (aq) ⇌ [Ni(CN) 4] 2-(aq) Jawab: Teori Arrhenius serta teori Brønsted-Lowry tidak bisa menjelaskan reaksi diatas.