
Contoh Senyawa Ion Dan Senyawa Kovalen Polar Yang Tergolong Zat Sexiz Pix
Ikatan SH merupakan contoh ikatan kovalen yang dianggap polar, meskipun tidak memenuhi syarat beda keelektronegatifan. Dalam hal ini, perbedaannya adalah 0,38, yang akan menempatkannya dalam kelompok ikatan kovalen nonpolar, namun, ahli kimia setuju bahwa ikatan tersebut sebenarnya bersifat polar. -Iklan-.
Senyawa Kovalen Polar Pengertian, Sifat, Ciri Beserta Contohnya
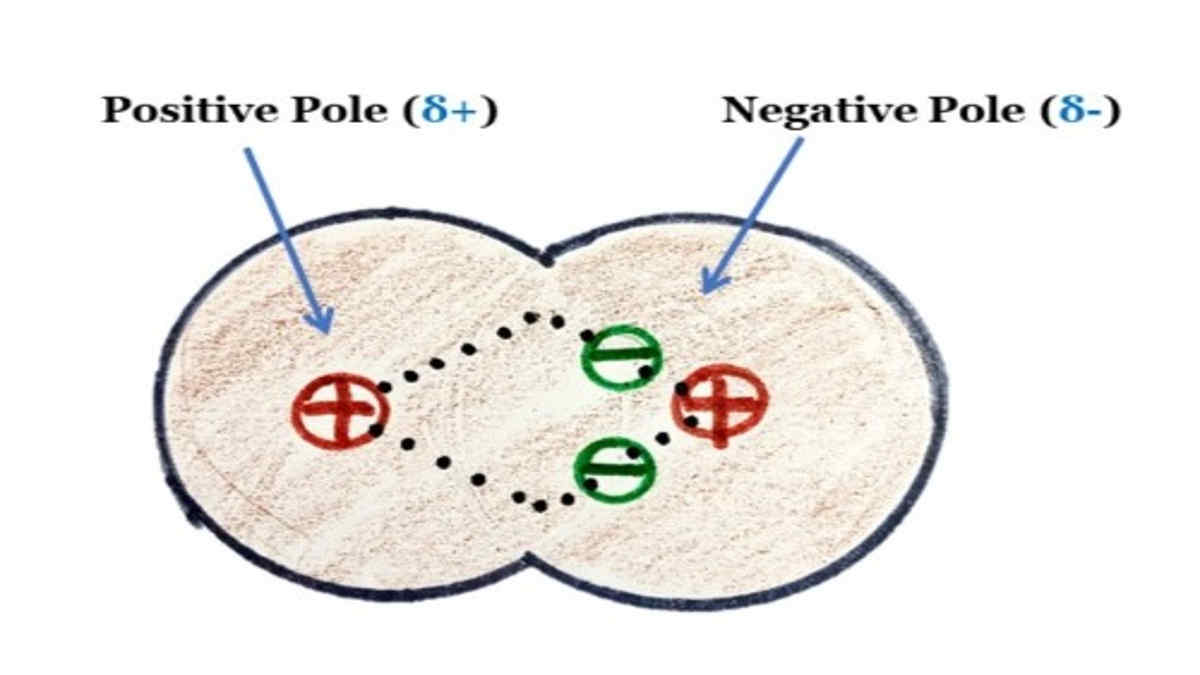
Perbedaan keelektronegatifan Atom-atom dalam senyawa kovalen menyebabkan terjadinya kutub positif dan negatif dalam senyawanya sehingga membentuk ikatan kova.

10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
2. Ikatan Kovalen Non Polar. Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara (sama). Biasanya terjadi ketika ada atom mempunyai afinitas elektron yang sama atau hampir sama. Semakin dekat nilai afinitas elektron, maka semakin kuat ikatannya.

X.2.f. Ikatan Kovalen Tunggal, Rangkap Dua, dan Rangkap Tiga (Teori) YouTube
Hal ini kemudian dinamakan sebagain ikatan kovalen nonpolar. Contoh ikatan kovalen nonpolar: I 2, Br 2, H 2, N 2. Misalnya pada I 2 dimana elektron digunakan oleh dua inti atom I. Oleh karena keelektronegatifannya sama besar, maka tidak terjadi pengutuban atau polarisasi. Perhatikan gambar di bawah ini. contoh ikatan kovalen non polar. b.

🔴IKATAN KOVALEN POLAR & NON POLAR, 🔴SENYAWA KOVALEN POLAR DAN SENYAWA KOVALEN NONPOLAR YouTube
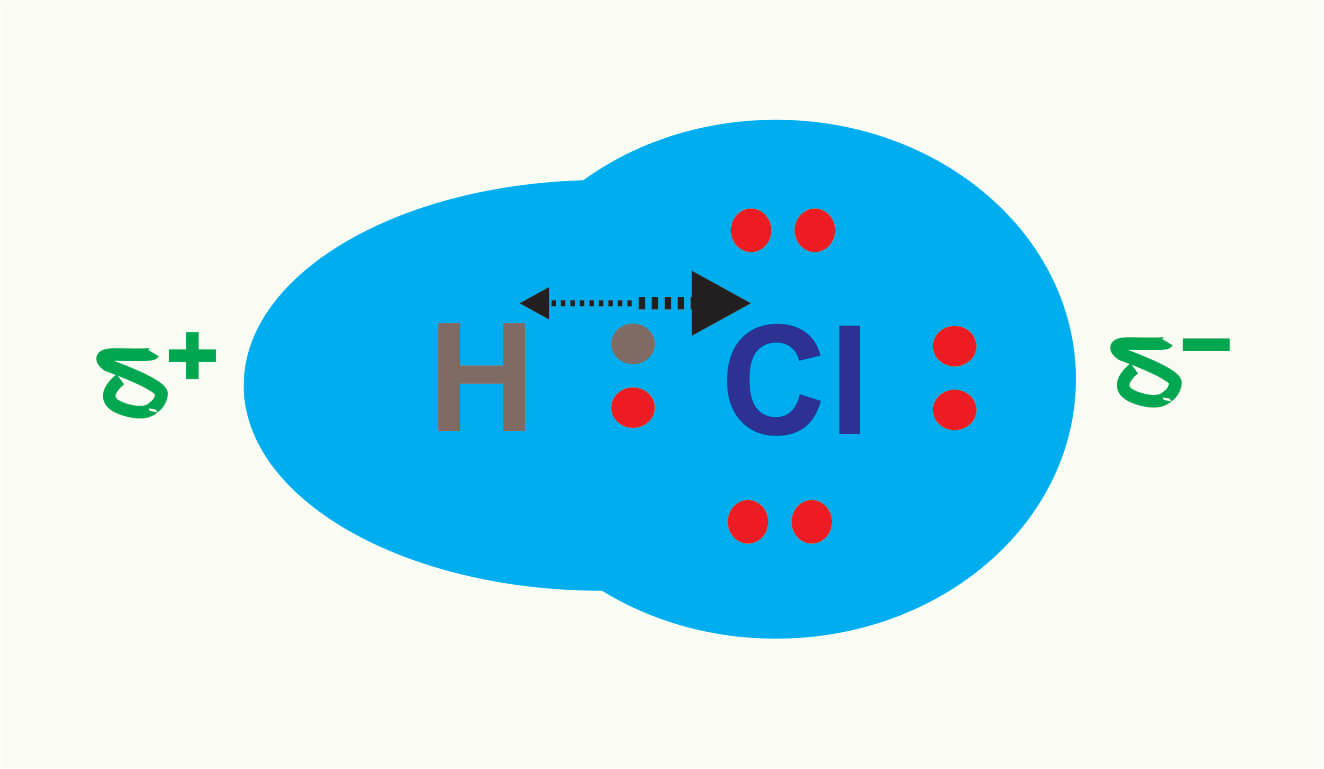
Ikatan kovalen polar adalah ikatan kovalen yang terbentuk antara atom-atom yang memiliki perbedaan elektronegativitas. Contoh ikatan kovalen polar adalah senyawa HF. Atom H memiliki elektronegativitas 2,20. dan atom F memiliki elektronegativitas 3,98. Artinya terdapat perbedaan elektronegativitas sebesar 1,78.
10 Contoh Soal Dan Pembahasan Ikatan Kovalen Polar Dan Nonpolar Materi Kimia Riset
Kalau ikatan kovalen nonpolar, pasangan elektron ikatannya akan sama kuat ke semua atom, di mana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak. Nah, itu dia jenis-jenis ikatan kovalen.

Sebutkan Senyawa Kovalen Polar Yang Dapat Menghantarkan Listrik
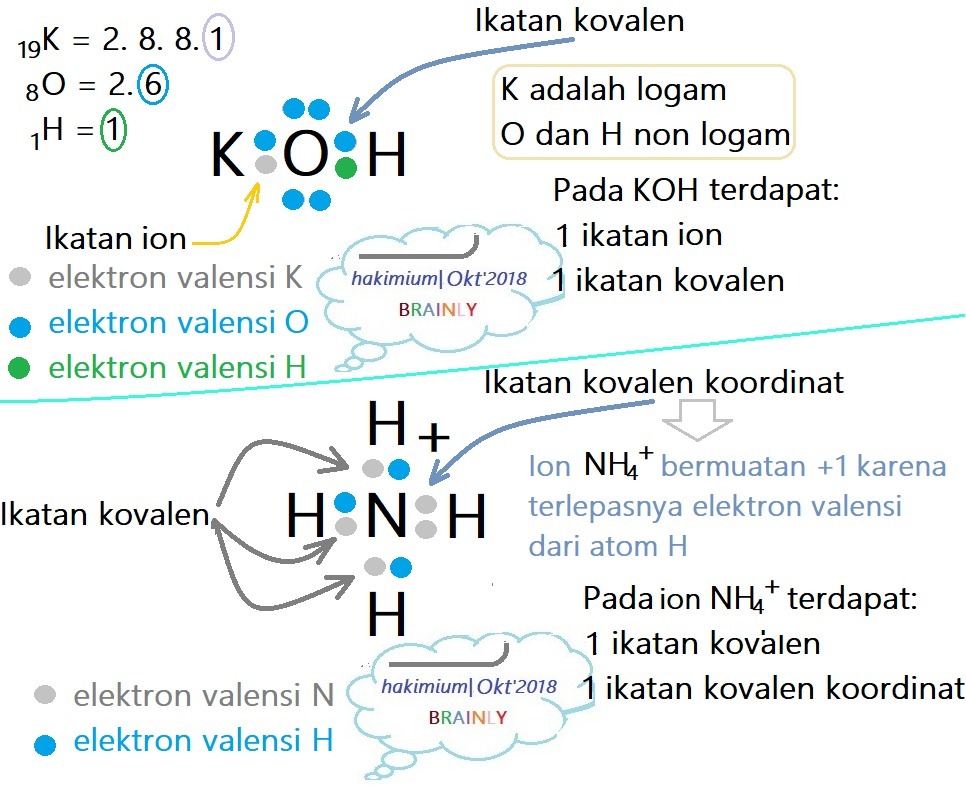
Ada tiga jenis ikatan Kimia, yaitu ikatan kovalen, ikatan logam dan ikatan ion. Sementara itu, dalam membentuk ion, suatu atom akan melepas atau mengikat elektron. Atom-atom yang mempunyai energi ionisasi rendah, misalnya atom-atom dari unsur golongan IA dan IIA dalam sistem periodik unsur akan mempunyai kecenderungan untuk melepaskan elektronnya.
Contoh Senyawa Kovalen Polar
1 H = 1. 53 I = 2 8 18 18 7. Struktur Lewis HI. H-I. Karena terdapat perbedaan keelektronegatifan, maka senyawa HI termasuk senyawa polar. 3. SiCl 4. Ikatan antara 14 Si dengan 17 Cl. 14 Si = 2 8 4. 17 Cl = 2 8 7. Struktur Lewsi SiCl 4. Karena atom pusat tidak memiliki pasangan elektron bebas (PEB), maka senyawa SiCl 4 termasuk senyawa nonpolar.. 4.

Ikatan Kovalen Polar Dan Nonpolar Beserta Contoh Ikatannya Rumus Kimia Sexiz Pix
Contoh senyawa kovalen polar meliputi air (H2O), amonia (NH3), dan asam klorida (HCl) serta alkohol. Berikut ini adalah beberapa contoh dari senyawa kovalen polar beserta dengan ikatan dan elektronegativitasnya selengkapnya. 1.Air (H2O) Ikatan: O-H. Elektronegativitas: O = 3.44, H = 2.2.
10 Contoh Ikatan Kovalen Polar dan Non Polar dalam Kehidupan Seharihari Materi Kimia
Senyawa kovalen non polar juga biasanya memiliki bentuk gas atau cair pada suhu kamar. Baca juga: Ikatan Kovalen Koordinasi: Pengertian dan Contohnya. Ikatan kovalen non polar terjadi karena kesamaan keelektronegativan atom-atom yang saling terikat. Di mana jika perbedaan keelektronegativan dua atom di bawah 0,4.

ecochemical Senyawa Kovalen Polar dan NonPolar
Hal ini dikenal dengan ikatan kovalen nonpolar. Pada contoh (b), pasangan elektron ikatan tertarik lebih dekat ke atom Cl karena Cl mempunyai daya tarik elektron lebih besar daripada H. Hal ini menyebabkan adanya polarisasi pada HCl, di mana atom Cl lebih negatif daripada atom H. Ikatan seperti ini dikenal dengan ikatan kovalen polar.

Contoh Senyawa Kovalen Polar Format Soal
What is a polar covalent bond? A polar covalent bond occurs when atoms are shared unequally in a covalent bond. Specifically, when the difference in electronegativities of the two atoms in the bond is between 0.4 and 1.7. The terms polar bond and polar covalent bond are generally used interchangeably.

Contoh Senyawa Ion Dan Senyawa Kovalen Polar Merupakan Senyawa Ion My XXX Hot Girl
A. Ikatan Kovalen Polar Ikatan kovalen polar adalah ikatan kovalen yang mengalami pengkutuban atau polarisasi yang disebabkan karena kepadatan elektron berkumpul di sekitar atom yang memiliki keelektronegatifan tinggi dan menjadikannya lebih negatif dari bagian lain. Contoh ikatan kovalen polar yaitu: 1. Ikatan Kovalen Polar H2O (Air) 2. Ikatan Kovalen Polar HCl (Asam klorida) 3.

TRIK MENENTUKAN IKATAN KOVALEN POLAR KIMIA OKE PINTAR
Molekul senyawa berikut yang bukan merupakan senyawa kovalen polar adalah.. A. HCl. B. H 2 O. C. NH 3. D. CHCl. E. Cl 2. Jawaban: E Pembahasan: Molekul Cl 2 terdiri dari 2 atom yang sama yaitu Cl sehingga selisih keelektronegatifannya adalah 0. Hal tersebut tidak mengakibatkan terjadinya pemisahan kutub oleh karena itu Cl 2 adalah senyawa nonpolar.. Soal No. 2
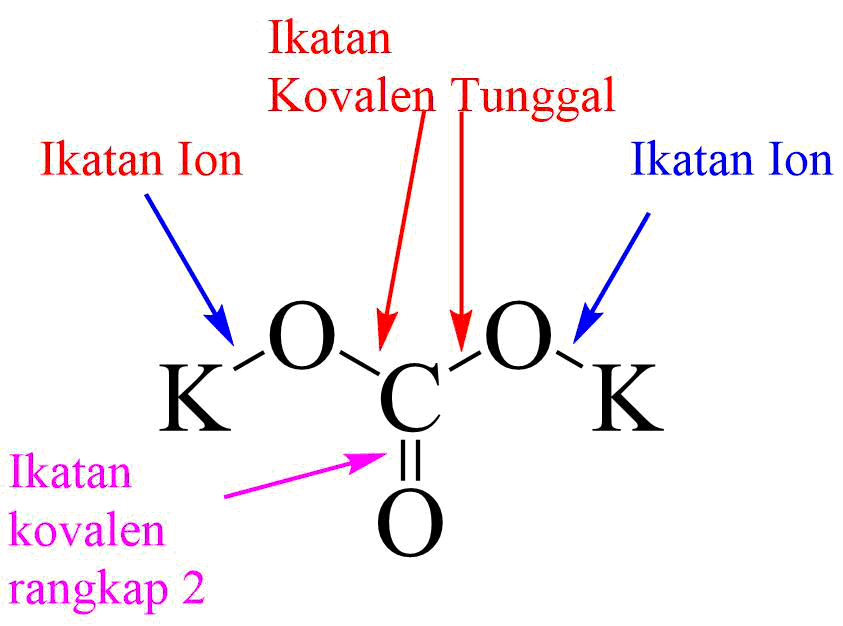
pengertian senyawa ion dan senyawa kovalen polar Matt Jackson
Molekul air adalah contoh penting dari ikatan kovalen polar yang menghasilkan momen dipol yang signifikan. 2. Metana (CH4) Metana adalah molekul yang terdiri dari satu atom karbon (C) dan empat atom hidrogen (H) yang terikat secara kovalen. Setiap atom hidrogen berbagi pasangan elektron dengan atom karbon melalui ikatan kovalen nonpolar.

Covalent Bond Types
Adapun contoh ikatan kovalen rangkap tiga adalah C 2 N 2 , CO, dan N 2. Agar lebih jelas, yuk simak pembahasan berikut mengenai ikatan kovalen rangkap tiga.. Ikatan kovalen non polar adalah ikatan yang terbentuk ketika pasangan elektron yang digunakan bersama-sama dari atom yang sama memiliki keelektronegatifan yang sama-sama kuat sehingga.