
Pengertian Konjugasi Dalam Ilmu Kimia Sains Kimia
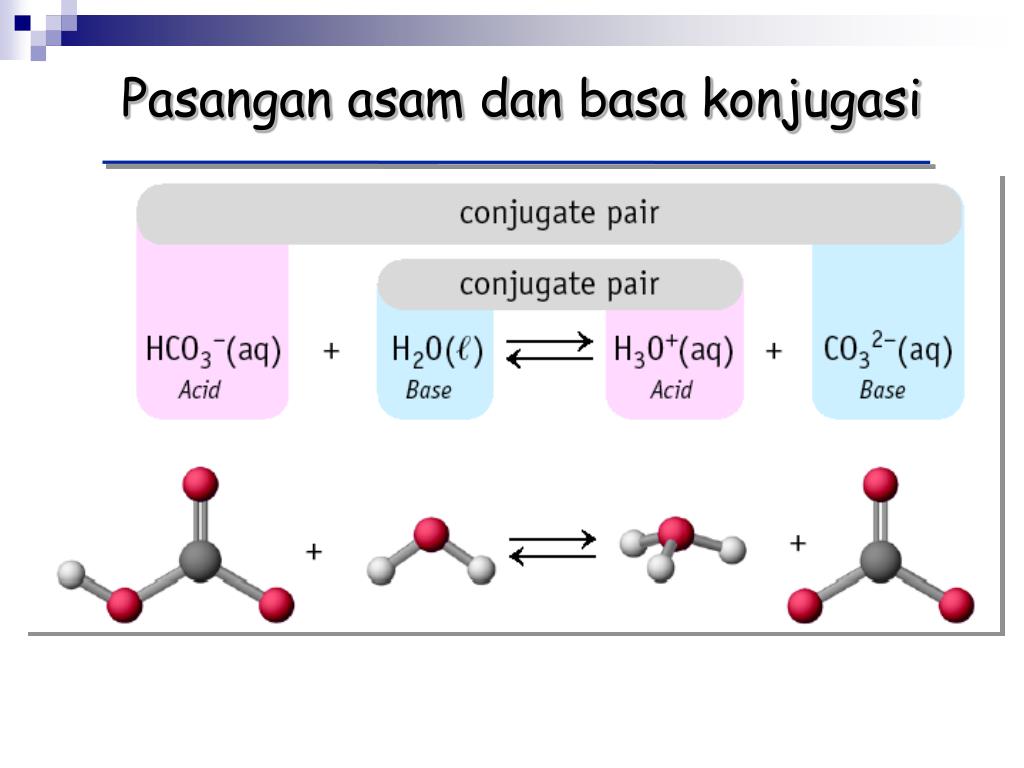
H 2 O adalah basa konjugasi dari H 3 O + dan H 3 O + adalah asam konjugasi dari H 2 O. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.

Mana yang berfungsi sebagai asam, basa, asam konjugasi, d...
Asam basa konjugasi adalah zat dengan sifat asam dan zat dengan sifat basa dapat berpasangan. Berikut cara menentukan pasangan asam basa konjugasi. 10 Contoh Peristiwa Perubahan Energi yang Terjadi Sehari-hari. Skola. 07/03/2024, 10:00 WIB. Contoh Encoding dalam Komunikasi. Skola. 07/03/2024, 09:00 WIB. 5 Bedanya Perikanan Air Payau dan Air.

(DOC) Asam Basa Konjugasi abdul bari Academia.edu
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Asam dan Basa Konjugasi
Dengan kata lain, asam konjugasi adalah anggota asam, HX, dari sepasang senyawa yang berbeda satu sama lain dengan mendapatkan atau kehilangan proton. Asam konjugasi dapat melepaskan atau menyumbangkan proton. Basa konjugasi adalah nama yang diberikan untuk spesies yang tersisa setelah asam menyumbangkan protonnya.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.

Tugas Kimia Dasar Asam Basa Konjugasi UR Studocu
Teori-teori Asam Basa Menurut Para Ahli. Para ahli mengemukakan pendapatnya mengenai teori asam basa. Setiap ahli memiliki pandangan yang berbeda, sehingga menciptakan teori-teori asam basa. Berikut beberapa teori asam basa menurut para ahli. Kimia Dasar 2 Ed 3: Raymond Chang. 1.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID4714427
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Asam lemah: HA + H 2 O ⇌ H 3 O + + A - (basa kuat) Basa sesaat setelah menerima proton akan berubah menjadi asam konjugasi dari basa tersebut. Contoh tipe reaksi: Basa kuat: B + H + → BH + (asam lemah) Bila ditulis secara lengkap: Basa kuat: B + H 3 O + → BH + (asam lemah) + H 2 O. Basa lemah: B + H + ⇌ BH + (asam kuat) Bila ditulis.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Konsep Asam Basa dalam bentuk pdf pada link dibawah ini: Modul Konsep Asam Basa; Kumpulan Soal Mudah, Sedang & Sukar. dan asam konjugasi yakni spesi dari basa yang telah mendapat proton. Dari teori ini diketahui beberapa asam yang bersifat diprotik (mampu melepas dua proton.

Asam basa konjugasi kimia SMA YouTube
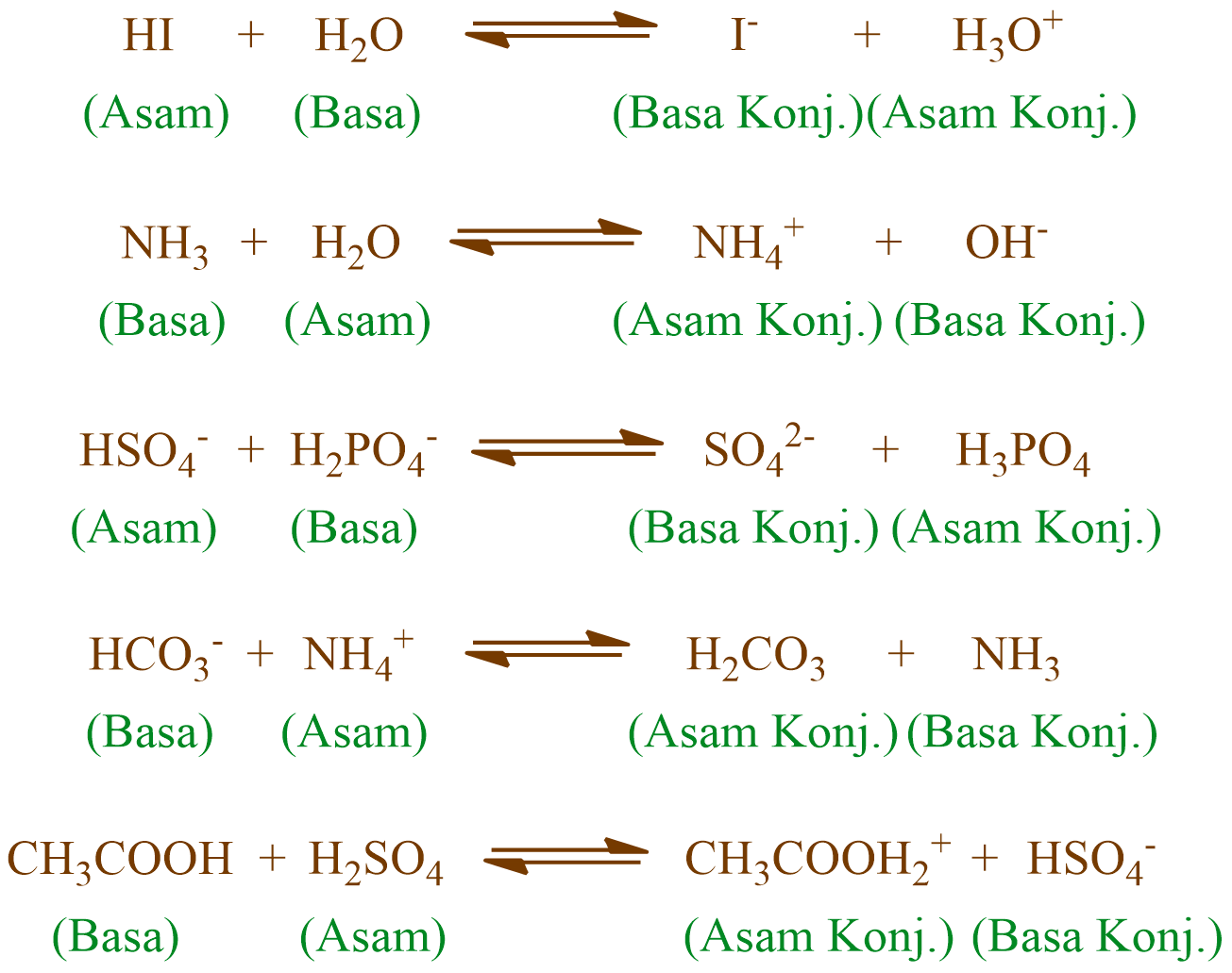
Jika basa konjugat lebih stabil dari asam, maka asam akan cenderung berdisosiasi dan menjadi lebih kuat, sedangkan jika sebaliknya maka akan menjadi asam lemah. Contoh asam:pasangan basa konjugasi. Berikut adalah beberapa contoh tambahan dari berbagai asam dan basa konjugatnya masing-masing: Asam klorida dan anion klorida (HCl dan Cl -)

Asam basa konjugasi soal kimia SMA YouTube
KOMPAS.com - Menurut teori Bronsted Lowry, asam adalah spesies yang dapat mendonorkan proton.Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry!. Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya.. Artinya, asam melepaskan proton (H+) untuk mencapai.
Contoh Soal Materi Konjugasi Materi Soal
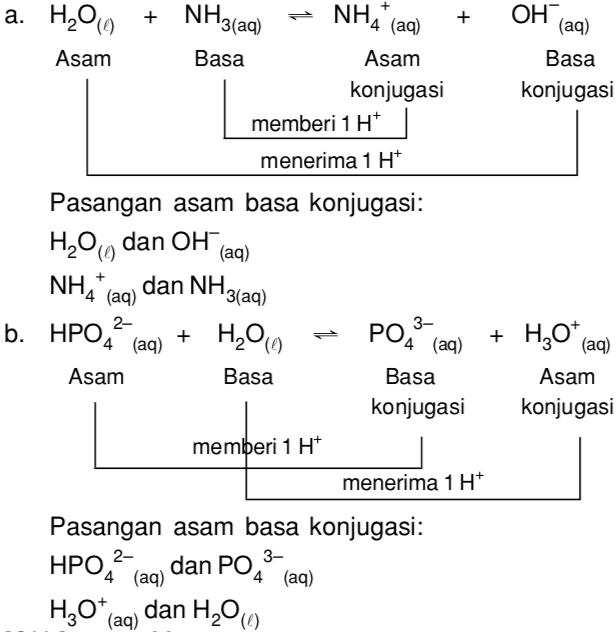
tentukan pasangan asam basa konjugasi dari reaksi berikut ! NH3(aq) + H2O(l)⇔ NH4 + (aq) + OH - (aq) Penyelesaian : pasangan asam basa konjugasi dari persamaan diatas adalah H2O/ OH - dan NH4 + / NH3. 3. Teori asam basa Lewis. Menurut teori asam basa Lewis. asam adalah spesi yang mampu menerima pasangan elektron (akseptor elektron) .

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
2. Konstanta Disosiasi Asam: Pasangan asam basa konjugasi memiliki nilai konstanta disosiasi asam (Ka) yang berbeda. Ka menyatakan sejauh mana asam akan melepaskan protonnya dalam larutan. Semakin besar nilai Ka, semakin kuat asam tersebut. Sebagai contoh, asam asetat (CH3COOH) memiliki basa konjugasi asetat (CH3COO-) dengan Ka yang lebih kecil.

Asam konjugasi soal kimia SMA YouTube
Berdasarkan teori asam basa Bronsted-Lowry, jika dalam suatu reaksi asam dan basa, apabila asam mendonorkan protonnya, maka akan dihasilkan spesies basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan spesies asam konjugasi. Nah, itulah yang dimaksud dengan pasangan asam dan basa konjugasi. Untuk lebih mudahnya, perhatikan 23 pasangan asam dan basa konjugasi berikut: No. Asam

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.