
Contoh Basa Kuat Dan Basa Lemah Beserta Rumus Kimianya Bit CDN
Hidrolisis garam merupakan reaksi reversible penguraian garam oleh air. Reaksi ini bekerja pada salah satu ion-ion garam (kation atau anion) dengan air sehingga membentuk larutan bersifat asam atau basa. Sifat asam atau basa yang dihasilkan pun bergantung pada jenis asam basa yang membentuk garam tersebut. Misalnya garam yang terbentuk dari.

Daftar Asam Basa Kuat Dan Lemah
Dapatkan pemahaman yang lebih dalam tentang tabel asam basa kuat dan lemah dalam kimia! Temukan perbedaan dan karakteristik masing-masing asam dan basa yang membuat mereka menjadi kuat atau lemah. Menyajikan informasi yang bermanfaat untuk pengajar dan siswa kimia. Nikmati pembahasan lengkap dengan contoh-contoh yang menggugah rasa ingin tahu Anda di artikel ini.
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Hidrolisis parsial atau sebagian bisa terjadi ketika garam dari asam lemah dan basa kuat atau sebaliknya. Pada hidrolisis sebagian ini, hanya salah satu ion yang akan mengalami reaksi hidrolisis dan yang lainnya tidak.. CH3COONa(aq) → CH3COO-(aq) + Na+ (aq)

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Pengertian Moderator: Apa Itu dan Apa Perannya? Sifat Asam Asetat Asam asetat adalah sejenis asam lemah. Ketika larutan asam asetat dilarutkan dalam air, sebagian molekulnya akan terionisasi menjadi ion hidrogen (H+) dan ion asetat (CH3COO-). Namun, sebagian besar molekul asam asetat tetap utuh dan tidak terionisasi.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
1. Berbahaya jika terhirup dalam jumlah banyak dan dapat menyebabkan iritasi pada saluran pernapasan2. Dapat menyebabkan iritasi pada kulit dan mata3. Berbahaya jika tertelan dalam jumlah besar dan dapat menyebabkan mual, muntah, dan diare4. Dapat terbakar saat terkena api atau panas tinggi5.

Ch3cooh Asam Atau Basa RadarMadiun.co.id
Soal #1: Berapakah pH setelah penambahan 0,002 mol HCl pada 100 mL larutan penyangga yang terdiri dari 0,50 M CH 3 COOH dan 0,50 M CH 3 COONa ? (pKa CH 3 COOH = 4,76 ) Pembahasan Soal #1: pH sebelum penambahan HCl pH sebelum penambahan HCl dapat dihitung seperti biasanya. pH = pKa + log ( [garam]/ [asam]) pH = 4,76 + log (0,50/0,50)

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Pada saat titik ekuivalen maka didalam larutan hanya terdapat garam, untuk kasus titrasi asam lemah CH3COOH dengan NaOH maka garam yang terbentuk adalah CH3COONa yaitu garam yang terbuat dari asam lemah dan basa kuat. Garam ini akan terhidrolisis sebagian. Gunakan rumus pH garam pada titik ekuivalen.

Daftar Asam Basa Kuat dan Lemah
Asam asetat memiliki rumus molekul CH3COOH dan berat molekul sekitar 60,5 gram per mol. Cairan cernih berbau dan berasa asam Asam asetat (CH3COOH) merupakan asam dengan bentuk cairan jernih (tidak berwarna). Namun, memiliki bau asam yang menyengat juga rasa yang asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
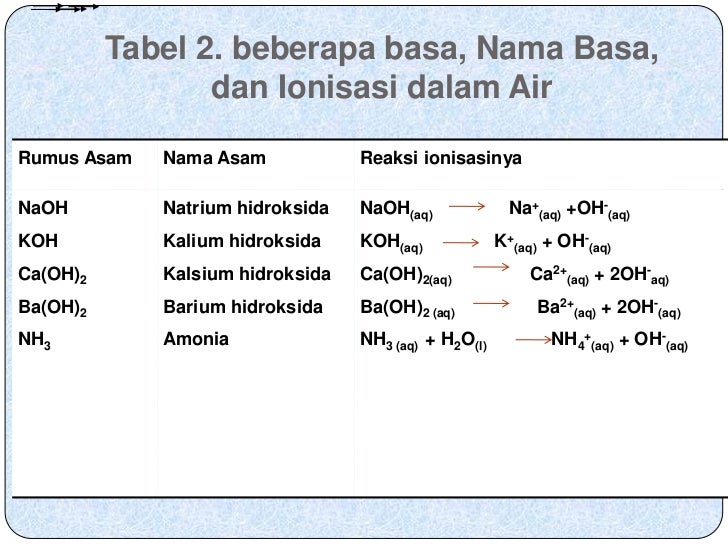
Larutan garam yang bersifat netral yaitu garam yang terbentuk dari asam kuat dan basa kuat atau terbentuk dari asam lemah dan basa lemah. Contoh : NaCl , CH3COONH4 Larutan garam yang bersifat asam yaitu garam yang terbentuk dari asam kuat dan basa lemah. Contoh : NH4Cl, Al2 (SO4)3

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Asam + basa → garam + air. HCl + KOH → KCl + H2O. Garam dapur (NaCl) diperoleh dari air laut yang mengalami penguapan dan kristalisasi. Untuk menjadikannya garam beryodium, harus diproses iodisasi (garam kalium/KI). Sifat-sifat atau ciri-ciri garam: Larut dalam air. Contohnya : KNO3, NH4Cl, Na2SO4. Sukar larut dalam air.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Garam dari asam kuat dan basa lemah Garam seperti NH 4 Cl yang dapat terbentuk dari reaksi asam kuat (HCl) dan basa lemah (NH 3) akan mengalami hidrolisis kation yang berasal dari basa lemah sehingga larutannya bersifat asam. Anion Cl − tidak terhidrolisis karena merupakan basa konjugasi yang sangat lemah.
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Kimia Hidrolisis - Kimia Kelas 11 - Teori, Jenis Reaksi, dan Contoh Soal by sereliciouz & Andjar Tyassih, S.Si. Agustus 28, 2019 Dalam artikel ini akan dibahas secara detail tentang teori dan reaksi hidrolisis, jenis-jenis reaksi hidrolisis, contoh soal dan pembahasan reaksi hidrolisis, dan aplikasi reaksi hidrolisis dalam kehidupan sehari-hari.

Soal Pembahasan Larutan Penyangga Buffer Reaksi Asam Basa Lemah Dan Hot Sex Picture
150 2 Jawaban terverifikasi Iklan LL Lucintaa L Level 1 21 November 2021 15:39 Jawaban terverifikasi Garam CH3COONa akan bersifat basa di dalam air karena terhidrolisis sebagian, komponennya adalah asam lemah dan basa kuat. Bukti sifat basa tersebut karena di hasilkan OH- dari reaksi hidrolisis.
Daftar Asam Basa Kuat Dan Lemah
Sifat asam atau basa larutan yang dihasilkan hidrolisis garam bergantung pada jenis asam basa yang membentuk garam tersebut. Baca juga: Hukum Kekekalan Energi: Pengertian, Rumus, dan Penerapannya. Misalnya garam yang terbentuk dari asam kuat dan basa kuat, garam yang terbentuk dari asam kuat dan basa lemah, garam yang terbentuk dari asam lemah.
Daftar Asam Basa Kuat Dan Lemah
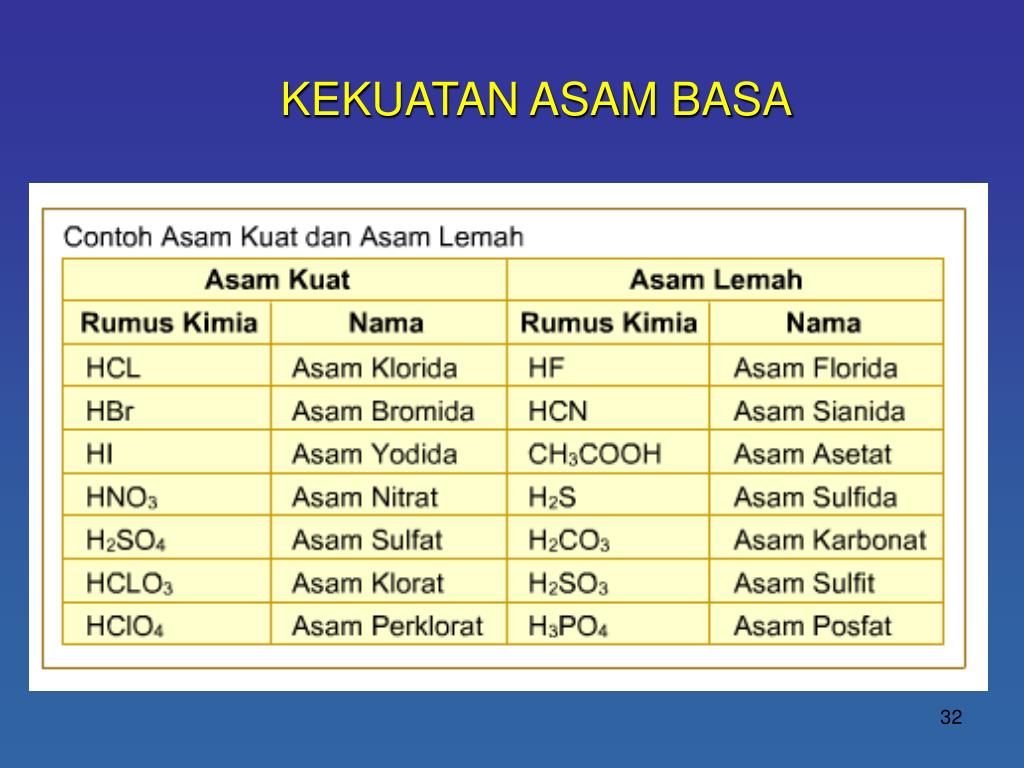
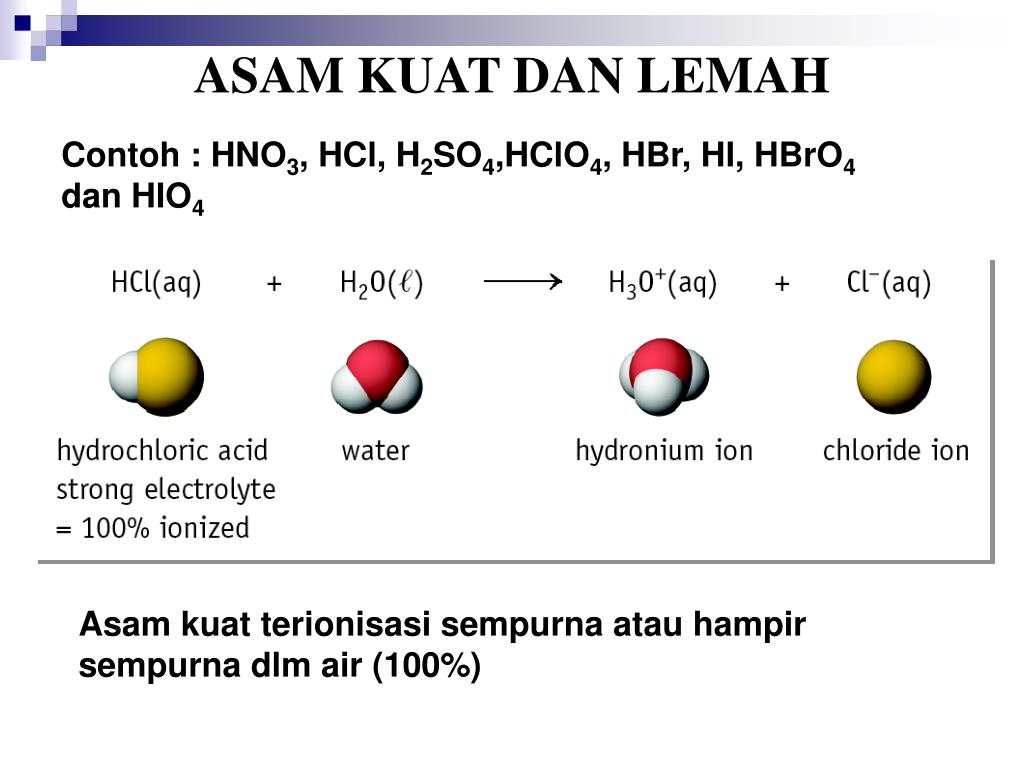
Berikut adalah daftar nama asam kuat: Asam klorida (HCl) Asam nitrat (HNO3) Asam sulfat (H2SO4) Asam klorat (HClO3) Asam perklorat (HClO4) Asam bromida (HBr) Asam hidrogen iodida (HI) Baca juga: Hujan Asam: Penyebab, Proses, Dampak, dan Cara Mencegahnya Asam lemah Asam lemah adalah larutan dengan pH di bawah tujuh dan di atas tiga.

MENENTUKAN VALENSI BASA kuat YouTube
Asam asetat (CH3COOH) adalah asam lemah yang dapat bereaksi dengan natrium hidroksida (NaOH) membentuk natrium asetat (CH3COONa) dan air (H2O). Natrium asetat memiliki kemampuan untuk menetralkan asam dan menjaga pH tetap stabil. Jenis larutan penyangga basa terdiri dari basa lemah dan garam yang terbentuk dari asam kuat dan basa lemah.