
Menghitung Fraksi Mol YouTube
Pengertian Mol dan Jumlah Partikel. Mol merupakan jumlah tertentu untuk menyatakan banyaknya suatu zat yang berukuran mikroskopis (berukuran kecil). Satu mol menunjukkan banyaknya partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan jumlah partikel dalam 12 gram atom C-12. Satu mol materi merupakan penyederhanaan jumlah partikel.

Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol YouTube
Baca tentang pengertian dan contoh soalnya, beserta cara menghitung mol dengan baik di bawah ini ya! Elo pasti suka nih minuman dengan rasa baik manis, asam atau bahkan asin. Tau nggak nih, rasa itu dihasilkan dari suatu padatan yang dilarutkan dalam cairan. Misalnya, untuk menghasilkan rasa manis, maka gula dilarutkan dalam air.
Konsep Mol pada Perhitungan Kimia
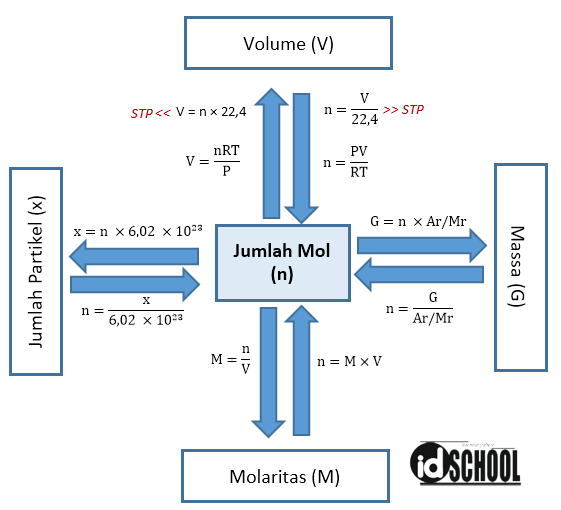
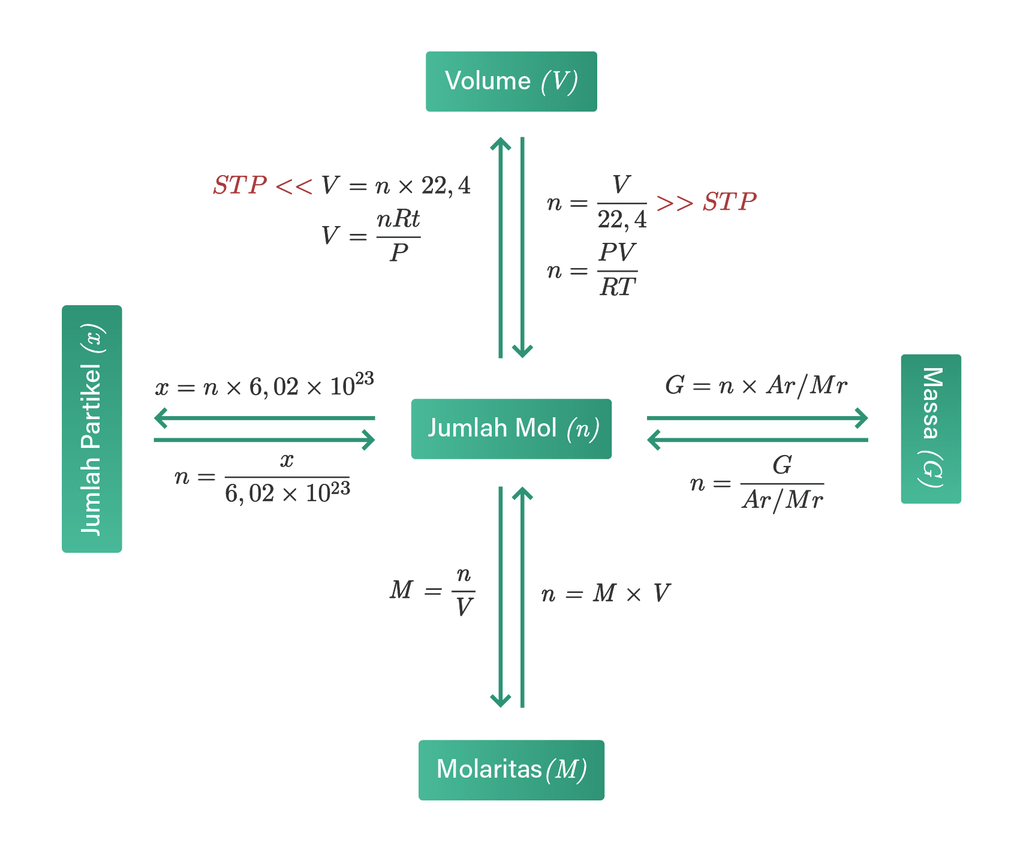
Langkah pertama: menghitung massa NaOH yang dibutuhkan. V = 500 mL = 0,5 L. M = 0,2 M. n = M x V. n = 0,2 mol/L x 0,5 L = 0,1 mol. massa NaOH = 0,1 mol x 40 gram/mol. massa NaOH = 4 gram. Langkah kedua: Menimbang 4 gram NaOH padat. Langkah ketiga: Memasukkan kristal NaOH yang telah ditimbang ke labu takar volume 500 mL. Setelah itu menambahkan.

CARA MUDAH MENGHITUNG FRAKSI MOL YouTube
Mengetahui massa molekul sangat diperlukan untuk mengubah gram menjadi mol. Kalikan jumlah atom dari masing-masing unsur yang terdapat di dalam senyawa dengan berat atom unsur tersebut. Jumlahkan total berat dari masing-masing unsur dalam senyawa. Misalnya, (NH 4) 2 S memiliki berat molekul (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g/mol.

Konsep Mol dan Analisanya
Materi konsep mol. Bagaimana cara menghitung zat-zat yang bereaksi dalam suatu reaksi kimia? Para ahli kimia yang bergabung dalam IUPAC (International Union Pure and Applied Chemistry) sepakat menggunakan satuan yang disebut mol. Satu mol adalah jumlah partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan partikel yang terdapat dalam 12 gram atom C-12.
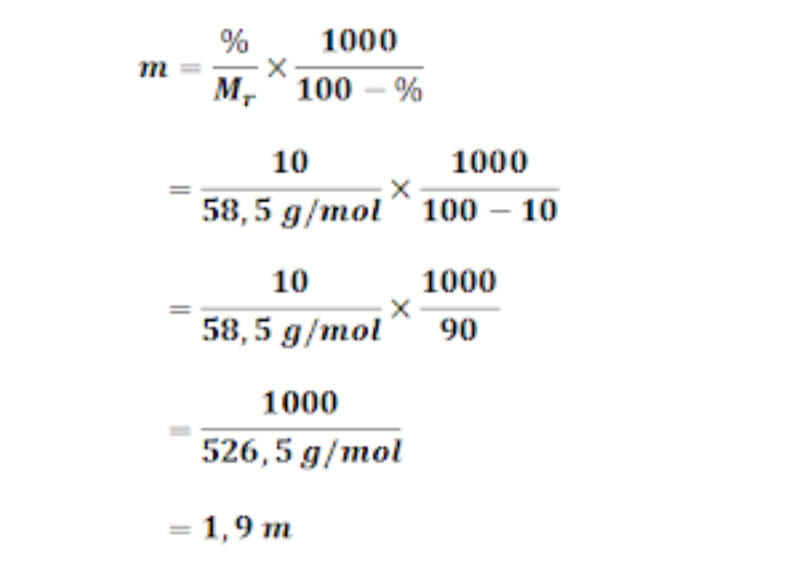
Cara Menghitung dan Contoh Soal Fraksi Mol dan Jawabannya Rumus dan Pembahasan Fraksi Mol
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

Cara mudah mencari molaritas atau konsentrasi larutan soal kimia SMA YouTube
Seperti soal sebelumnya, kita gunakan terlebih dahulu rumus mol namun terhadap volume gas STP. Selanjutnya kita bisa masukan ke dalam persamaan. Massa senyawa = Mr x Jumlah mol. 4,25 g = Mr x 0,125 mol. Mr = 34. Jadi, diketahui Mr dari 4,25 g gas dengan volume 2,8 L sebesar 34.

Cara Menghitung Fraksi Mol Sifat Koligatif Larutan YouTube
Fraksi Mol Zat Pelarut (X P); Selanjutnya ada rumus untuk mencari fraksi mol dari zat pelarut. Caranya mirip banget dengan yang tadi. Elo cukup memasukkan jumlah dari mol zat pelarut (n p), kemudian elo bagi dengan jumlah dari mol keseluruhan alias mol zat terlarut (n t) ditambah dengan mol zat pelarut (n p).. Biar lebih jelas, gue juga udah buat ilustrasinya di bawah ini.

Contoh Soal Molalitas dan Fraksi Mol larutan LABORATORIUM SMK
Contoh penggunaan rumus mol dalam kimia adalah dalam pembuatan larutan asam sulfat 0,1 M. Kita dapat menghitung massa asam sulfat yang diperlukan menggunakan rumus mol: Massa asam sulfat = volume x konsentrasi x massa molar. Jika kita ingin membuat 500 ml larutan asam sulfat 0,1 M, maka: Massa asam sulfat = 0,5 liter x 0,1 mol/liter x 98 gram.

STOIKIOMETRI (PERHITUNGAN KIMIA) PART I KONSEP MOL DAN CARA MENGHITUNG MOL, Mr DAN MOLARITAS
Setelah mempelajari mol & konsep stoikiometri, maka kita telah menguasai dasar-dasar dari salah satu cabang kimia yakni kimia analitik, yang berkutat mengenai jumlah zat dan perubahannya dalam reaksi. Untuk mulai belajar materi & contoh soal Mol & Stoikiometri dan penyelesaiannya kamu bisa langsung klik daftar materi dibawah ini.
Cara menghitung mol...
Contoh soal: gram terlarut * (1/massa molar terlarut) = 3,4 g * (1 mol / 158 g) = 0,0215 mol. 5. Bagilah jumlah mol dengan banyaknya liter. Karena kamu sudah memiliki jumlah mol, kamu bisa membaginya dengan banyaknya liter larutan untuk mencari molaritas. Contoh soal: molaritas = mol terlarut / liter larutan = 0,0215 mol / 5,2 L = 0,004134615. 6.

Menghitung Mol dari Volume (Kimia SBMPTN, UN, SMA) YouTube
Step : Menghitung mol gas H 2. Mol = Volume / 22.4. Mol H 2 = 1.5 / 22.4 = 0.0669 mol. Jika diketahui konsentrasi; Konsentrasi merupakan satuan ukuran untuk suatu larutan. Jika dalam larutan tersebut diketahui jenis zat dan konsentrasinya serta jumlah volume total larutan, maka anda dapat menghitung jumlah mol zat tersebut.

Menghitung Jumlah mol jika diketahui Massa Molar Zat dan Massa Molekul Relatif YouTube
Nah, rumus molekul ini digolongkan menjadi dua, yaitu rumus molekul unsur dan rumus molekul senyawa. 1. Rumus Molekul Unsur. Rumus molekul unsur adalah rumus yang menyatakan gabungan atom-atom yang sama jenis unsurnya lalu membentuk sebuah molekul. Nah, molekul unsur dibagi lagi menjadi dua berdasar dari jumlah atom yang bergabung.

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Rumus Fraksi Mol Zat Terlarut. Secara matematis, fraksi mol zat terlarut dirumuskan sebagai berikut. Dengan: x ter = fraksi mol pelarut (indeks "ter" bisa diganti sesuai nama zat terlarutnya); n pel = mol pelarut; dan. n ter = mol zat terlarut. Rumus Mol. Jika kamu diminta untuk menentukan mol dari suatu zat yang diketahui massanya, gunakan.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Rumus menghitung mol suatu senyawa yaitu : n = gram/Mr. Keterangan: n = mol suatu zat (mol) Mr = massa molekul relatif suatu zat (gram/mol) gr = massa suatu zat (gr). Maka fraksi mol garam dapur dan fraksi mol air bisa dihitung dengan cara : Mol garam dapur, nG = 5,85/58,5 =0,1 mol Mol air, nA = 90/18 = 5 mol Fraksi mol garam dapur,.

Latihan Soal Konsep Mol YouTube
Seperti yang kita lakukan dalam cara pertama untuk menghitung massa molar suatu unsur, kita juga mengalikan massa-massa ini dengan 1 gram/mol. Massa atom relatif unsur-unsur dalam asam hidroklorida adalah: hidrogen, 1,007 g/mol dan klorin, 35,453 g/mol.