
Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
Laju Reaksi: Pengertian, Rumus, Contoh, Soal. Februari 12, 2024 Oleh Eka, S.Si. Banyak reaksi yang terjadi di sekitar kita dengan kecepatan (laju reaksi) yang berbeda-beda. Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.

Menentukan Orde Reaksi Laju reaksi kimia kelas 11 YouTube
Semakin cepat reaksi berlangsung, maka harga tetapan laju reaksi semakin besar. Dan berbanding lurus dengan perubahan suhu. Semakin tinggi suhu reaksi, semakin besar harga tetapan laju reaksinya. Cara menentukan tetapan laju reaksi dapat dilakukan setelah diketahui orde reaksi. Untuk lebih mudahnya perhatikan contoh soal berikut.

Laju Reaksi Pembentukan Gas Hidrogen YouTube
Salah satu cara menentukan persamaan laju reaksi adalah dengan mengamati persamaan reaksi pada tahap tambat. Tahap lambat ini biasa sudah ditentukan pada soal. Tahap lambat memang sering disebut tahap penentu laju reaksi. Ketika ingin menentukan persamaan laju reaksi cukup memperhatikan zat-zat di ruas kiri tanda panah, atau zat-zat pereaksi.

Contoh Soal Laju Reaksi Beserta Pembahasannya Belajar Siswa
Katalis atau katalistor adalah zat yang ditambahkan untuk mempercepat laju reaksi dengan cara menurunkan energi aktivasi tanpa mengalami perubahan hingga akhir proses.. yakni fungsi semua pereaksi yang menentukan laju reaksi k = Tetapan reaksi yang dipengaruhi suhu dan katalis [A] = konsentrasi zat A [B] = konsentrasi zat B x = orde reaksi.

laju reaksi, rumus laju reaksi, orde laju reaksi UN kimia 2016 pembahasan 23 YouTube
Pengertian Laju Reaksi. Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:

Cara mudah Laju reaksi (latihan soal UN)kimia sma(1) YouTube
Penting untuk mempertimbangkan konsentrasi reaktan, suhu sistem, dan keberadaan katalis atau enzim ketika menentukan laju reaksi. Karena laju reaksi sering kali sulit diukur, satu-satunya cara untuk benar-benar mengamati dan memahami faktor-faktor yang mempengaruhinya adalah melalui eksperimen dan analisis data.

Hukum Laju Reaksi Elementer YouTube
Semangat pagi.Di Vidio ini, kita akan belajar cara mudah menentukan persamaan laju reaksi dan orde reaksi.jadi, untuk menentukan persamaan laju reaksi dan.

Persamaan Laju Reaksi Dan Orde Reaksi Sma Syarif Hidayatullah Grati My XXX Hot Girl
FAQ 2: Bagaimana cara menentukan laju reaksi jika reaksi tersebut tidak dapat diamati secara langsung? Terkadang, terdapat reaksi kimia yang tidak dapat diamati secara langsung, misalnya reaksi antara zat-zat organik yang berlangsung dalam lingkungan tertutup. Dalam kasus seperti ini, ada beberapa metode yang dapat digunakan untuk menentukan.

Kimia part 4 Hukum Laju Terintegrasi Orde 1 YouTube
r = 80.000 [NO]² [H2]¹. cara menentukan orde reaksi. Bagaimana cara mencari laju reaksi jika diketahui waktu? Untuk menjawab pertanyaan tersebut. Terlebih dulu kita perhatikan contoh soal laju reaksi berikut. Dari reaksi H2 dan NO diperoleh data sebagai berikut. [H2]awal (M) [NO]awal (M) Waktu (detik) 0,1 0,1 80 0,2 0,1 40 0,2 0,2 10 Tentukan.

Persamaan laju reaksi contoh soal kimia SMA YouTube
Jika pereaksi A dibuat berlebih, maka konsentrasi A selama percobaan dapat dianggap konstan. Dari sini, kita dapat menentukan laju reaksi dari B yaitu vB. Dengan cara yang sama, jika konsentrasi B dibuat berlebih, maka kita dapat menentukan laju reaksi dari A yaitu vA, sehingga laju reaksi keseluruhan untuk reaksi ini adalah:
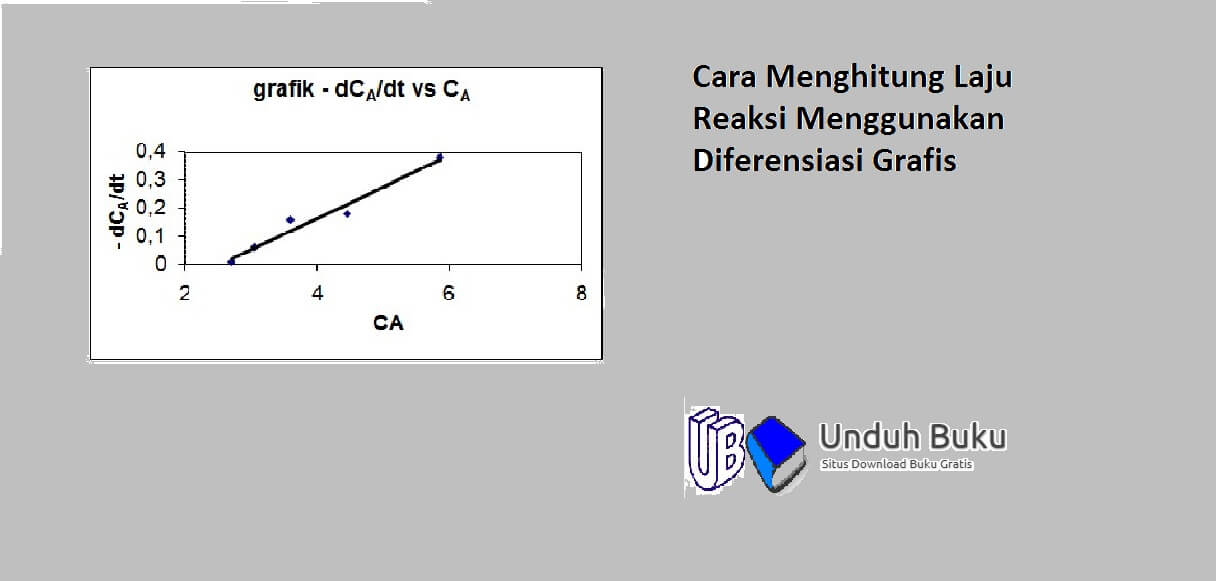
Cara Menghitung Laju Reaksi Menggunakan Diferensiasi Grafis
B. Persamaan Laju Reaksi. Persamaan laju reaksi adalah fungsi dari semua pereaksi yang menentukan laju reaksi. Persamaan laju reaksi juga dikenal dengan hukum reaksi. Persamaan laju reaksi dapat dituliskan sebagai berikut : xA + yB → produk. Rumus Persamaan Laju Reaksi. v = k [A]m [B]n. Keterangan: v = laju reaksi [A] = konsentrasi zat A

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Molaritas A dibuat tetap, sedangkan molaritas B diubah-ubah, kemudian waktu atau laju reaksi diukur dengan cara tertentu. Demikian pula sebaliknya, untuk menentukan laju reaksi terhadap B, maka molaritas B dibuat tetap molaritas A diubah-ubah. Perhatikan contoh berikut ini: Contoh Soal dan Penyelesaian. 1).

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA ADA YANG TIDAK SAMA YouTube
c. r O2 = - ½ x r SO3 = - ½ x 0,0125 = - 0,00625 M/s. Jadi, laju berkurangnya O2 sebesar - 6,25 x 10-3 M/s. Itulah ulasan tentang Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan terimakasih. Baca juga refrensi artikel.

Cara menentukan Laju Reaksi terhadap Pereaksi () dan terhadap Produk/hasil reaksi (+) YouTube
Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban. Ilustrasi dan sumber foto: PINTERpandai.com [Royalty Free] Beberapa hal yang harus dipahami terlebih dahulu sebelum menentukan persamaan laju reaksi adalah sebagai berikut:

Cara menentukan persamaan laju reaksi jika diketahui data percobaan tidak ada yang sama YouTube
0,0725 M/detik. Pembahasan:Mula-mula, kamu harus menentukan laju reaksi gas P yang merupakan reaktan. Oleh sebab itu, konsentrasi gas P akan terus berkurang, sehingga perubahan konsentrasinya bernilai negatif. Dengan demikian, laju reaksi rata-rata pembentukan gas PQ pada selang waktu 8 sampai 16 detik adalah sebagai berikut.

Persamaan laju reaksi orde reaksi Kimia SMA YouTube
Menentukan Persamaan Laju Reaksi. Persamaan laju suatu reaksi tidak memiliki hubungan dengan stoikiometri reaksi, tetapi ditentukan melalui percobaan, salah satu metode yang sering digunakan adalah metode laju awal. Menurut cara ini, laju diukur pada awal reaksi dengan konsentrasi yang berbeda-beda. Sebagai contoh pada reaksi antara HCl dan.