
TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
Asam kuat. Asam kuat terdisosiasi sempurna dalam air, membentuk H + dan anion. Ada enam asam kuat. Yang lain dianggap asam lemah. Anda harus memasukkan asam kuat ke memori: Jika asam 100 persen terdisosiasi dalam larutan 1,0 M atau kurang, itu disebut kuat.

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Dengan cara ini diharapkan Anda bisa membedakan mana saja golongan zat asam yang termasuk asam kuat dan mana saja golongan asam yang termasuk asam lemah. Baca juga : Beo Jantan. Cara membedakan asam kuat dan asam lemah ini bisa dilakukan dengan 4 cara yang sangat mudah. Adapun keempat cara tersebut yaitu:

Cara Menghitung PH Larutan Asam Kuat Dan Asam Lemah Panduan Kimia + Riset
Asam Lemah. Asam lemah tidak sepenuhnya terdisosiasi menjadi ion-ionnya dalam air. Sebagai contoh, HF berdisosiasi menjadi ion H + dan F - dalam air, tetapi beberapa HF tetap berada dalam larutan, sehingga bukan merupakan asam kuat. Ada lebih banyak asam lemah daripada asam kuat. Sebagian besar asam organik adalah asam lemah.

MENGHITUNG / MENENTUKAN pH ASAM KUAT DAN ASAM LEMAH YouTube
Baca juga Cara Menentukan Derajat Keasaman dan Kebasaan (pH dan pOH) Zat. Memahami Kekuatan Asam dan Basa Zat. Pada dasarnya, cara mengetahui kekuatan asam dan basa bisa dilakukan dengan melihat ion yang ada dalam sebuah larutan. Sekedar informasi, ion adalah sekelompok atom atau atom yang bermuatan listrik.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Perbedaannya, asam kuat adalah asam yang mudah terurai. Sedangkan asam lemah merupakan asam yang terion sebagian atau sulit terurai. Sekarang kita simak macam-macam contoh asam kuat dan asam lemah, yuk! Baca Juga: Sifat Zat dan Hubungannya dengan Partikel Penyusunnya: Sifat Fisika, IPA Kelas 9 SMP. Contoh Asam Kuat. 1. Asam klorida (HCl) 2.

🔴pH ASAM KUAT & pH ASAM LEMAH ‼️🟢PEMBAHASAN SOAL pH ASAM KUAT & pH ASAM LEMAH YouTube
Buku Interaksi Alam Basa Dalam Kehidupan menulis, menurut sumber asalnya, asam dibedakan menjadi 2 yakni asam organik dan asam anorganik. - Asam organik Asam organik merupakan asam yang banyak terdapat pada bahan makanan yang disebut asam karboksilat, dengan kandungan ikatan C - H atau C - O. Asam ini juga kerap dipakai untuk campuran bahan kosmetik.

Trik Super Kilat Membedakan Asam kuat / Asam lemah & Basa kuat / Basa lemah YouTube
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.

pH Campuran asam Lemah dan Asam KuatKimia SMA YouTube
Klasifikasi Asam dan Basa. Di atas sudah disebutkan bahwa larutan asam dan basa dibagi menjadi dua jenis, yaitu kuat dan lemah. Kira-kira apa maksudnya? Mari kita bahas satu-satu, ya! Asam Kuat dan Basa Kuat. Asam kuat, singkatnya, merupakan senyawa asam yang dapat dengan mudah melepaskan ion H+ di dalam air dan dalam larutannya terjadi.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Asam dan basa merupakan dua jenis larutan yang kerap digunakan dalam kehidupan sehari-hari manusia. Asam dan basa ada yang memiliki sifat kuat dan juga lemah. Berikut daftar nama asam kuat, asam lemah, basa kuat, dan juga basa lemah: Asam kuat dan asam lemah. Asam adalah larutan dengan pH di bawah tujuh.

Cara Mengitung pH Larutan Asam Kuat, Asam Lemah, Basa Kuat, Basa Lemah YouTube
Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat konsentrasi asam dengan pH 1 daripada 3.

daftar nama asam basa kuat dan lemah.docx
Kita ambil contoh reaksi asam HNO3 dan basa Ca(OH)2. 2HNO3 + Ca(OH)2 → Ca(NO)2 + 2H2O. Untuk menghasilkan reaksi di atas, maka dibuat penyetaraan antara reaktan dan produknya. Reaksi Oksida Asam dan Oksida Basa. Selain itu, ada juga nih yang namanya oksida asam dan oksida basa. Oksida asam umumnya unsur non logam yang berikatan dengan oksigen.

PERHITUNGAN pH ASAM LEMAH DAN BASA LEMAH YouTube
Cara cepat membedakan senyawa yang termasuk asam kuat atau asam lemah dan senyawa yang termasuk basa kuat atau basa lemah.Cara atau trik dalam video ini dibu.
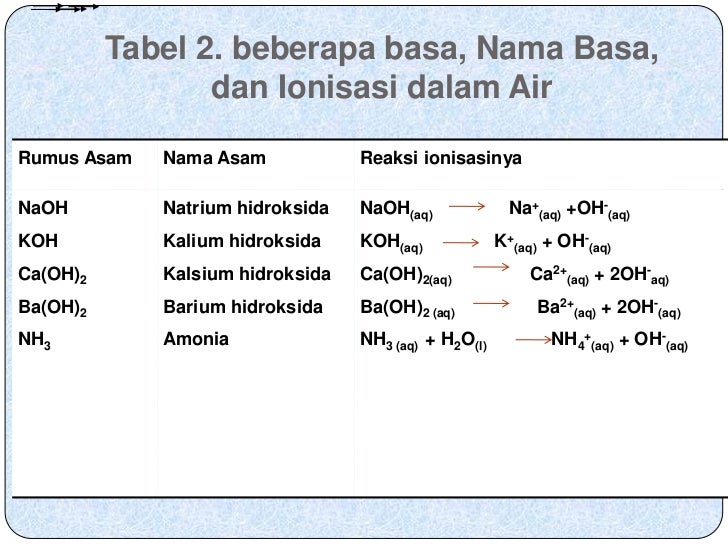
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.

Cara Menghitung Ph Larutan Asam Kuat Dan Asam Lemah Panduan Kimia Riset Sexiz Pix
A. Tetapan ionisasi asam (K a). Secara umum, reaksi kesetimbangan larutan asam HA dalam air dapat ditulis sebagai berikut. HA(aq) ⇌ H + (aq) + A − (aq). Tetapan ionisasi asam K a dapat dirumuskan seperti berikut.. asam kuat (contoh: HCl, HBr, HI, HNO 3, HClO 4, H 2 SO 4); Dalam air, hampir seluruh asam kuat terurai menjadi ion-ionnya, sehingga derajat ionisasi α ≈ 1.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
4. Titrasi Basa Lemah oleh Asam Kuat. Titrasi basa lemah oleh asam kuat, artinya: Titran (larutan standar pada buret) → asam kuat ; Titrat (larutan sampel pada labu erlenmeyer) → basa lemah; Titrasi basa lemah oleh asam kuat akan menghasilkan kurva sebagai berikut. Baca Juga: Bagaimana Cara Menentukan Indikator Asam Basa? Rumus Titrasi Asam.

Cara Menghitung pH dan pOH Asam Kuat dan Basa Kuat YouTube
Tabel Nilai Ka Umum untuk Asam Lemah. K a adalah tetapan kesetimbangan untuk reaksi disosiasi asam lemah . Asam lemah adalah asam yang hanya terdisosiasi sebagian dalam air atau larutan berair. Nilai K a digunakan untuk menghitung pH asam lemah . Nilai pKa digunakan untuk memilih buffer saat dibutuhkan. Memilih asam atau basa di mana pKa.