
Konsep mudah menentukan biloks Kimia SMA YouTube
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.

Penyetaraan Reaksi Redoks dengan Cara Biloks
Cth: SO4^2- biloks = -2. 4 O = 4x(-2) = -8. S = +6. SO4^2- = 6-8 = -2 . Senyawa AgNO3 dan AgCl memiliki biloks total = 0, sehingga perhitungan biloks Ag pada senyawa-senyawa tersebut adalah sebagai berikut: Biloks AgNO3 = biloks Ag + biloks N + (3x biloks O) 0 = biloks Ag + (+5) +(3x-2) 0 = biloks Ag + 5 - 6. Biloks Ag = +1 . Biloks AgCl.
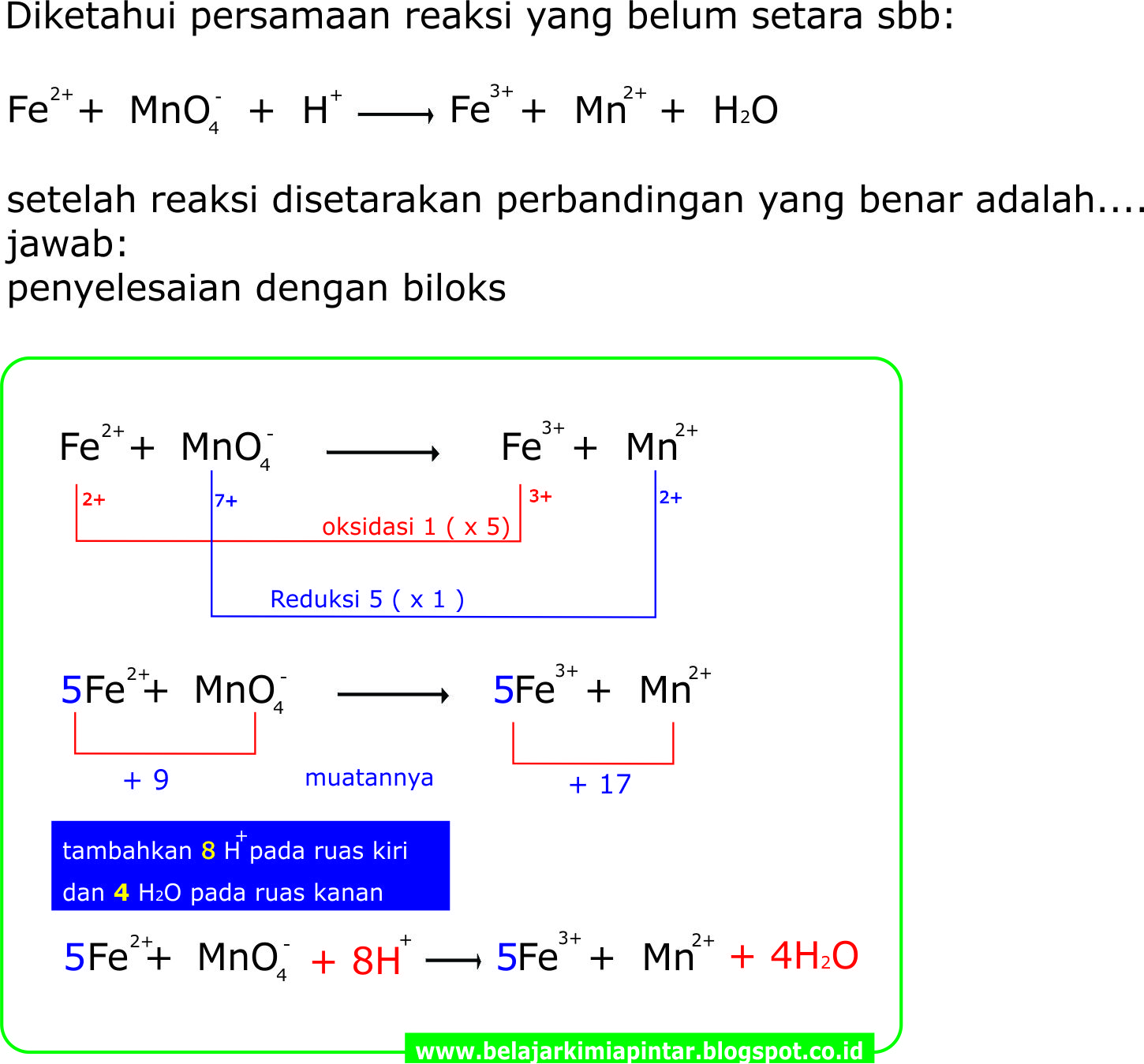
TRIK PENYETARAAN REAKSI REDOKS CARA BILOKS (SUASANA ASAM) KIMIA OKE PINTAR
Konsep Peningkatan dan Penurunan Bilangan Oksidasi (Biloks) Reduksi Penurunan Biloks Oksidasi Peningkatan Biloks Cr2O72- + Fe2+ Cr3+ + Fe3+ +6 +2 +3 +3 Reduksi Oksidasi Penentuan Bilangan Oksidasi a.. dan pada senyawa superoksida seperti KO2, RbO2 biloks O yaitu -1/2 . Sementara itu, pada F2O biloks dari O yaitu +2 f. Jumlah total biloks.

Cara menentukan Biloks ( Bilangan Oksidasi ) Reaksi Redoks YouTube
Ingat aturan biloks nomor 5, jumlah bilangan oksidasi unsur yang membentuk ion akan sama dengan jumlah muatannya. Jadi, biloks Cr dan O apabila dijumlah, hasilnya harus -2. Cr 2 O 7 2-Biloks O = -2. Karena atom O memiliki indeks 7, maka biloks O dikalikan dengan indeks O = -2 x 7 = -14. Agar jumlah biloks Cr dan O = -2, maka biloks Cr harus.
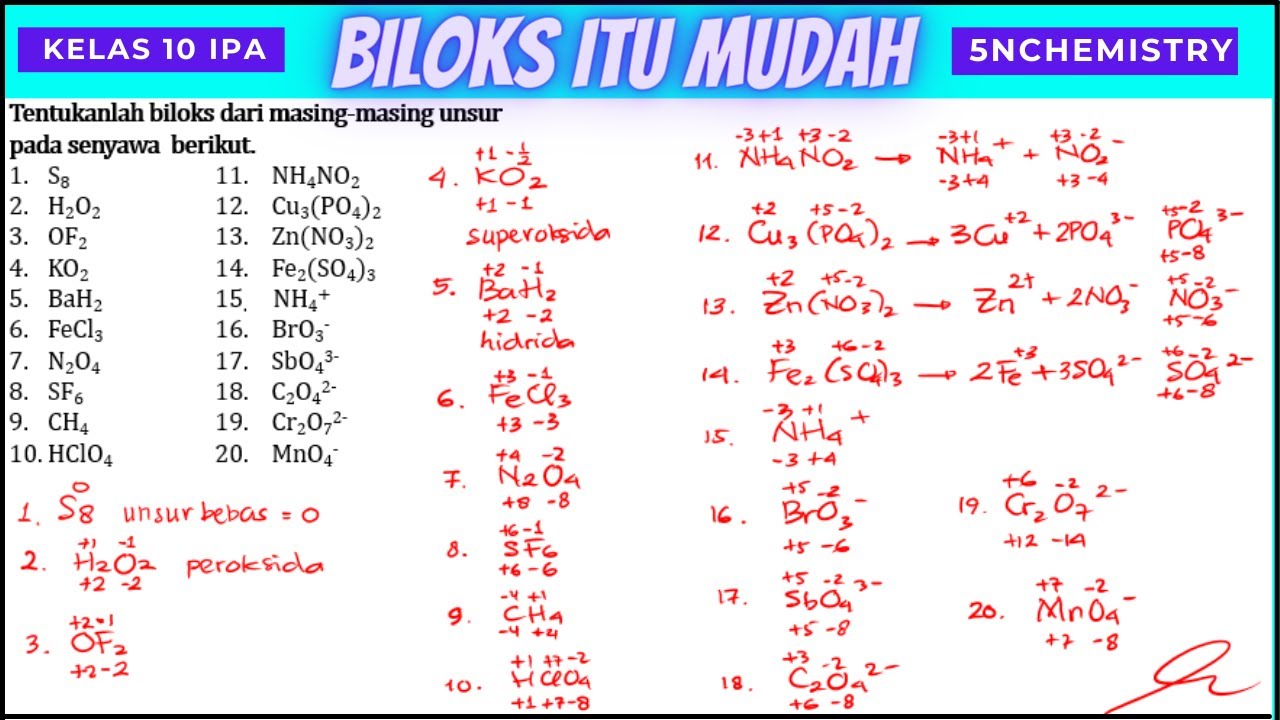
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.

PENYETARAAN REDOKS DENGAN CARA BILOKS UNTUK REAKSI ION (Part 1) YouTube
Potassium superoxide is an inorganic compound with the formula K O 2. [6] It is a yellow paramagnetic solid that decomposes in moist air. It is a rare example of a stable salt of the superoxide anion. It is used as a CO2 scrubber, H2O dehumidifier, and O2 generator in rebreathers, spacecraft, submarines, and spacesuits .

Tentukan bilangan biloks oksidasi atom atom h2o2, Mg3N2, KO2 Brainly.co.id
4) Oksigen memiliki biloks = -2, kecuali: • Dalam senyawa peroksida biloks O = -1. contoh dalam H2O2 dan Na2O2. • Dalam senyawa super peroksida biloks O = -½. contoh dalam KO2. 5) Bilangan oksidasi suatu senyawa = 0. 6) Bilangan oksidasi suatu ion = muatannya. 7) Unsur halogen sebagai halida memiliki biloks = -1. contoh: NaCl, MgCl2 dan KI.

biloks Cu biloks kimia kelas X YouTube
Biloks oksigen dalam senyawanya adalah -2, kecuali saat berada dalam senyawa peroksida biloksnya -1. 7. Jumlah bilangan oksidasi molekul sama dengan jumlah muatannya. Pada senyawa K₂O, bilangan oksidasi O telah diketahui sebesar -2 berdasarkan aturan penentuan bilangan oksidasi. Biloks K dapat ditentukan menggunakan cara berikut: Biloks K₂O.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
To calculate oxidation numbers of elements in the chemical compound, enter it's formula and click 'Calculate' (for example: Ca2+, HF2^-, Fe4 [Fe (CN)6]3, NH4NO3, so42-, ch3cooh, cuso4*5h2o ). The oxidation state of an atom is the charge of this atom after ionic approximation of its heteronuclear bonds. The oxidation number is synonymous with.

Aturan penentuan biloks
Dan dalam senyawa superoksida, KO2, biloks H = - ½. d. Biloks unsur logam selalu bernilai positif. Contoh: Biloks unsur golongan IA (H, Li, Na, K, Rb, Cs, Fr) = +1. Biloks unsur golongan IIA (Be, Mg, Ca, Sr, Ba, Ra) = +2.. Jumlah biloks dalam ion poliatomik, contoh PO43- = muatannya = -3 g. Biloks ion tunggal, contoh Na+ = muatannya = +1.
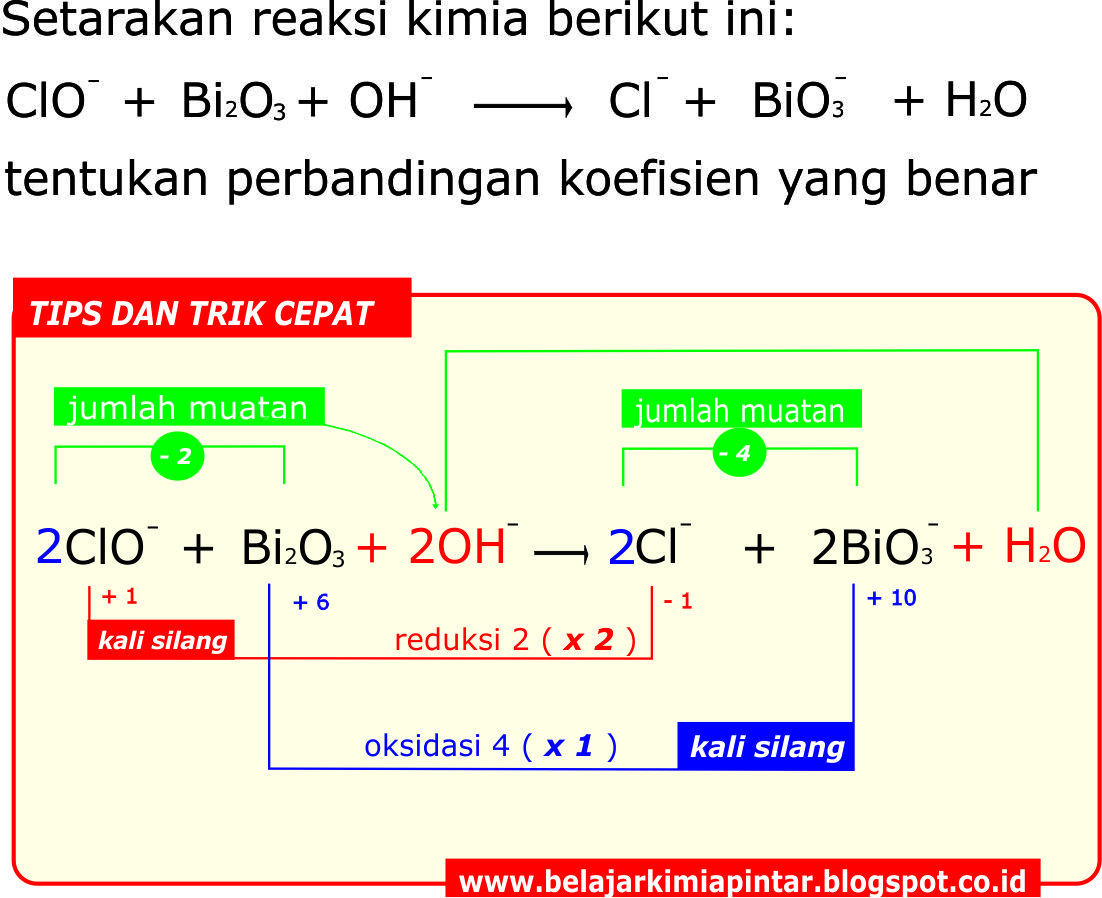
Trik Penyetaraan Reaksi Redoks Cara Biloks ( Suasana Basa ) KIMIA OKE PINTAR
Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation.

3 Contoh Soal Bilangan Oksidasi (Biloks) YouTube
Aturan penentuan biloks - Download as a PDF or view online for free. Submit Search. Upload.. Dalam senyawa superoksida bilangan oksidasinya adalah -1/2, seperti pada KO2 dan NaO2. g) Jumlah bilangan oksidasi untuk semua atom unsur dalam molekul atau senyawa adalah 0. Jumlah bilangan oksidasi untuk atom atau unsur pembentuk ion poliatom sama.

Cara Menentukan Biloks Berdasarkan Prioritas YouTube
Koof Unsur P x Biloks Unsur P + Koof Unsur NP x Biloks Unsur NP = 0 Agar sobat bisa lebih paham , silahkan sobat kerjakan contoh soal di bawah ini dengan menggunakan rumus-rumus diatas . Carilah biloks dari unsur-unsur yang terdapat di dalam senyawa ion berikut ini ! 1. Na dalam NaCl 6. Cr dalam CrCl3 2. Ag dalam AgBr 7. V dalam V2O5 3.

Cara Simpel Menentukan Biloks Unsur YouTube
Bilangan oksidasi dapat disebut juga dengan biloks. Dalam reaksi redoks, bilangan oksidasi digunakan untuk menentukan hasil reduksi dan hasil oksidasi dari suatu atom dan senyawa.. Dalam KO2, bilangan oksidasi O adalah -½ . Dalam F2O, bilangan oksidasi O adalah +2. Dalam peroksida ( H2O2,Na2O2, dan BaO2), bilangan oksidasi O adalah -1..

Kombucha KO2 (Bebida a Base de Té) 12oz Sabores Varios Amazonas Latin Market
Di artikel ini gue akan membahas lebih dalam tentang cara menentukan bilangan oksidasi hingga aturan biloks beserta contoh soalnya. Sebelumnya, elo udah belajar tentang cara menentukan reaksi redoks dan oksidasi. Kalau proses fotosintesis itu merupakan contoh reaksi redoks, di mana ada pengikatan atom H dan pelepasan atom O, sehingga atom H.

PENENTUAN BILANGAN OKSIDASI (BILOKS). YouTube
Biloks senyawa superoksida, seperti KO2 dan NaO2, bernilai = -½ . Bilangan oksidasi (Biloks) unsur O dalam H2O, KOH, H2SO4 dan Na3PO4 bernilai = -2 Jumlah pada bilangan oksidasi (Biloks) unsur-unsur pada senyawa adalah 0 (nol).