
Biloks & Penyetaraan Reaksi Redoks Metode Setengah Reaksi Reaksi Redoks Kimia Kelas 12 YouTube
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.

Biloks H Studyhelp
Bilangan Oksidasi Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation state.
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Ingat aturan biloks nomor 5, jumlah bilangan oksidasi unsur yang membentuk ion akan sama dengan jumlah muatannya. Jadi, biloks Cr dan O apabila dijumlah, hasilnya harus -2. Cr 2 O 7 2-Biloks O = -2. Karena atom O memiliki indeks 7, maka biloks O dikalikan dengan indeks O = -2 x 7 = -14. Agar jumlah biloks Cr dan O = -2, maka biloks Cr harus.

Penyetaraan Reaksi Redoks Metode Biloks Pada Kondisi Basa 1 YouTube
Word Equation. Iron + Sulfuric Acid = Iron (Ii) Sulfate + Dihydrogen. Fe + H2SO4 = FeSO4 + H2 is a Single Displacement (Substitution) reaction where one mole of solid Iron [Fe] and one mole of aqueous Sulfuric Acid [H 2 SO 4] react to form one mole of aqueous Iron (Ii) Sulfate [FeSO 4] and one mole of Dihydrogen [H 2] gas.
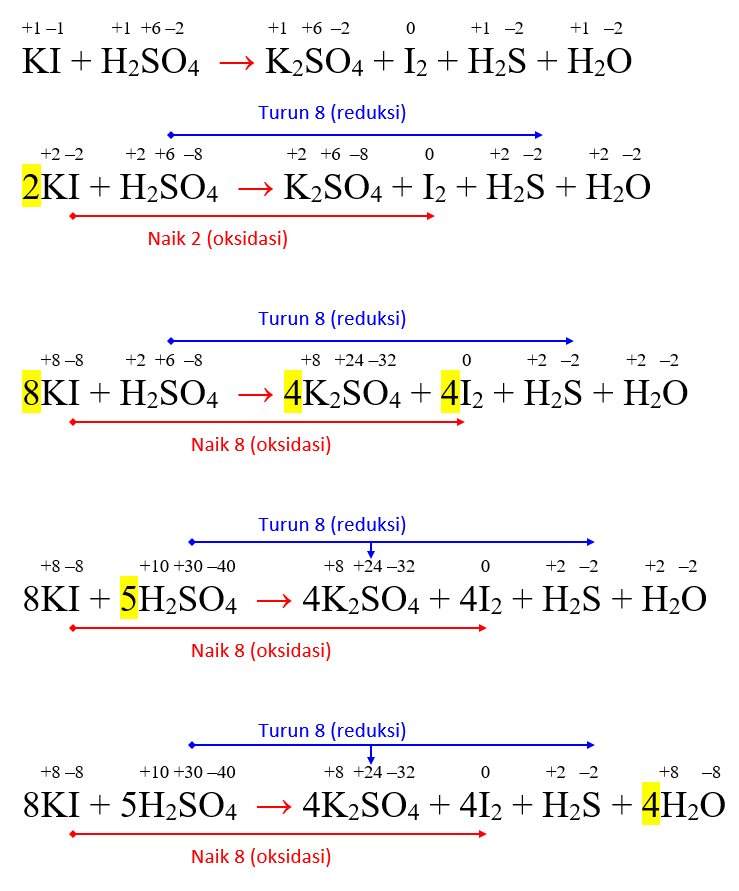
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Markas Belajar
Feb 22, 2024. Jan 22, 2024. H2 Green Steel raises more than €4 billion in debt financing for the world's first large-scale green steel plant. Jan 22, 2024. Jan 22, 2024. Jan 16, 2024. KIRCHHOFF Automotive and H2 Green Steel in €130 million deal for supply near zero emissions steel. Jan 16, 2024. Jan 16, 2024.

Reaksi Redoks2 Penyetaraan Reaksi Cara PBO/Biloks & Pembahasan Soal YouTube
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
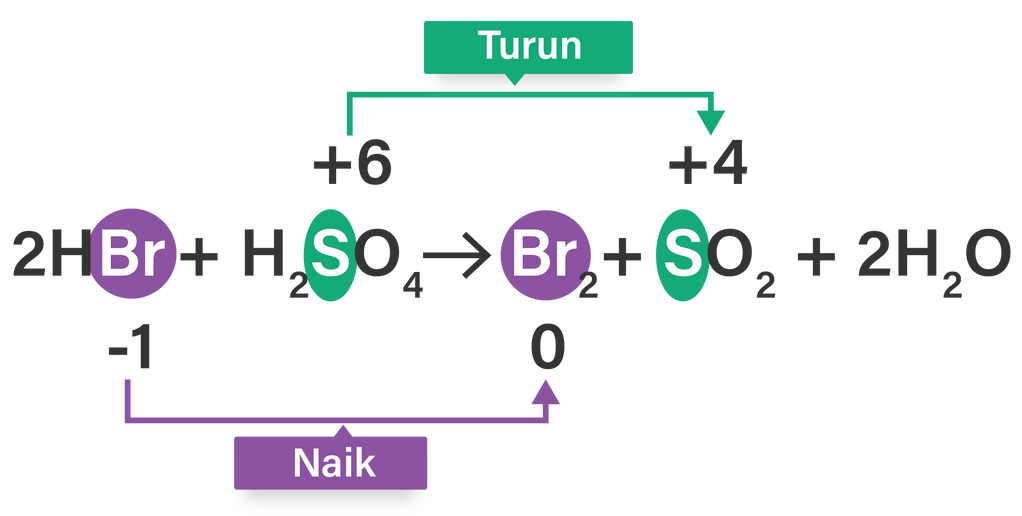
Diberikan persamaan reaksi redoks sebagai berikut....
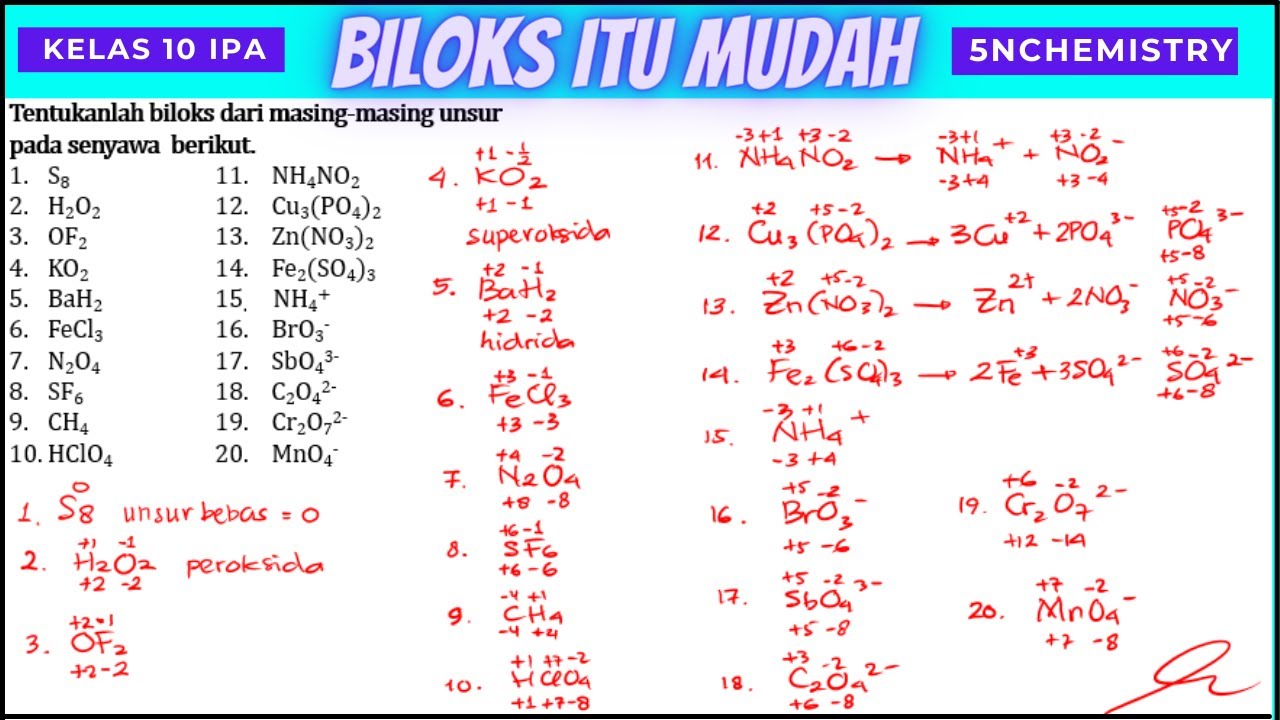
Sonia T. 18 Agustus 2020 06:35. Tentukan bilangan oksidasi unsur berikut ini! 1. Biloks H dalam senyawa H2O 2. Biloks N dalam senyawa NH3 3. Biloks S dalan senyawam H2SO4 4. Biloks N dalam senyawa NH4+ 5.Biloks Mn dalam senyawa Mn04-. 127.

Aturan Biloks Kls X PDF
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
H2 Green Steel has raised 4.75 billion euros ($5.17 billion) in new funding for its planned flagship plant in the northern Swedish town of Boden, which will be the world's first large-scale green.

PENYETARAAN REAKSI REDOKS DENGAN CARA BILOKS UNTUK REAKSI MOLEKUL (Part 2) YouTube
softwood under N2 and H2 atmosphere SHULE WANG KTH ROYAL INSTITUTE OF TECHNOLOGY SCHOOL OF INDUSTRIAL ENGINEERING AND MANAGEMENT. ABSTRACT Bio-oil generated from biomass is becoming one of the most promising alternatives as potential energy sources to replace fossil fuels in the transportation sector..

Perlukah Menghafal Aturan Bilangan Oksidasi? Urip dot Info
1. Setiap atom memiliki bilangan nol, jika dalam keadaan tidak bergabung. Atom tersebut adalah H2, Br2, Na, Be, K, O2, serta P4. Biloks ini disebut dengan unsur bebas. 2. Ion yang tersusun atas satu atom atau monoatom bilangan oksidasinya sama dengan muatan atom. Contohnya Na+, Mg2 dan Al3+ ialah +1, +2, dan +3. 3.
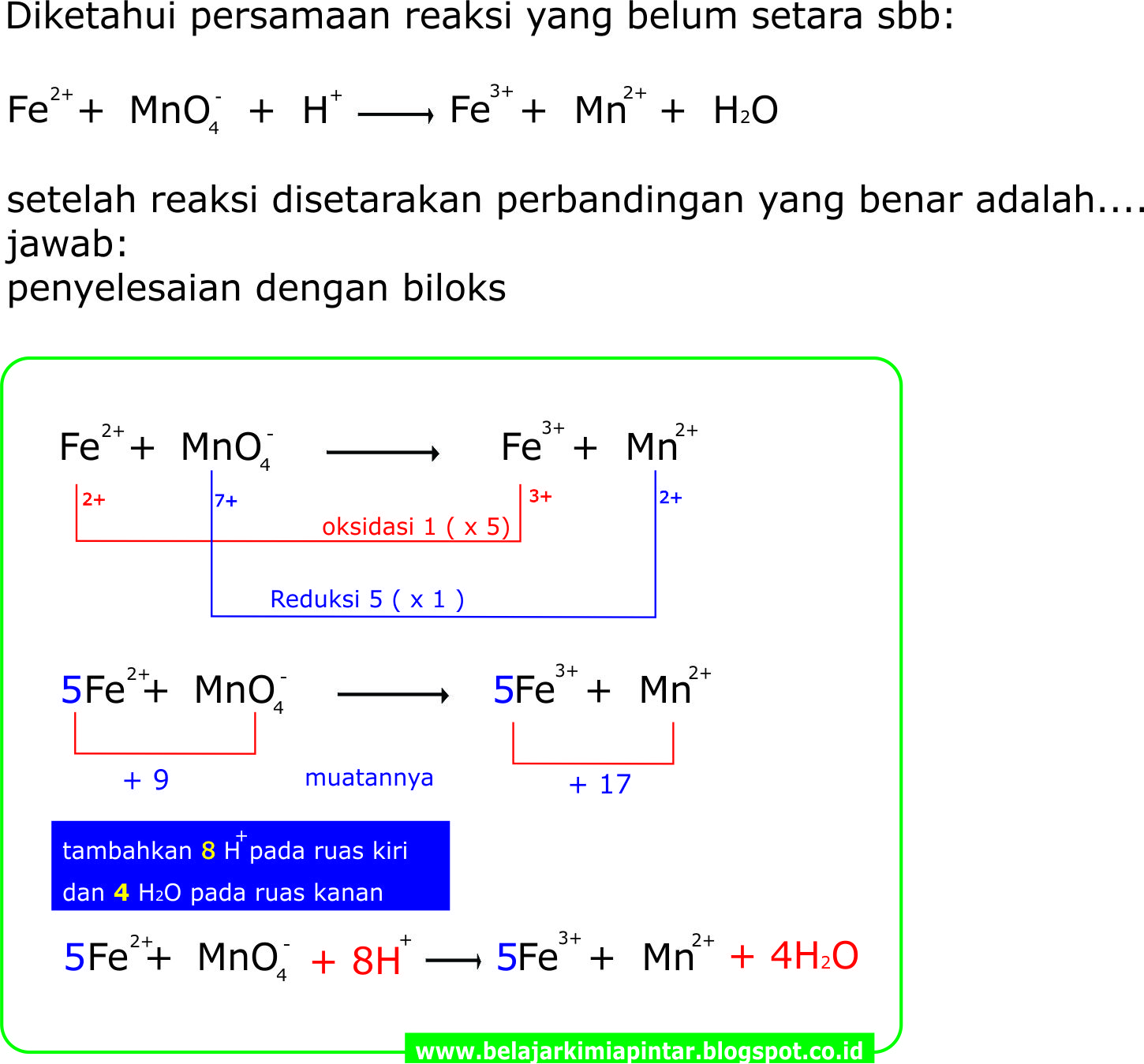
Contoh Soal Penyetaraan Reaksi Redoks Dengan Metode Biloks Berbagi My XXX Hot Girl
Reaksi : Bilangan oksidasi oksigen pada . adalah senyawa peroksida, sehingga biloks O tidak sama dengan -2, sehingga yang menjadi patokan adalah biloks unsur H yaitu +1. Maka biloks 2O = 0 - (2 x 1) = +2 biloks O = (-2 : 2) = -1. Bilangan oksidasi oksigen pada = 0 - (2 x 1) = -2. Bilangan oksidasi oksigen pada . merupakan molekul unsur.

PENYETARAAN REDOKS DENGAN CARA BILOKS UNTUK REAKSI ION (Part 1) YouTube
Ca + 2H2O = Ca (OH)2 + H2 is a redox reaction where Ca is oxidized and H is reduced. Ca is a reducing agent (i.e. it lost electrons) and H 2 O is a oxidizing agent (i.e. it gained electrons). Balance Using Half-Reaction (aka Ion-Electron) Method. Balance Using Oxidation Number Change Method. Balance Using Aggregate Redox Species (ARS) Method.
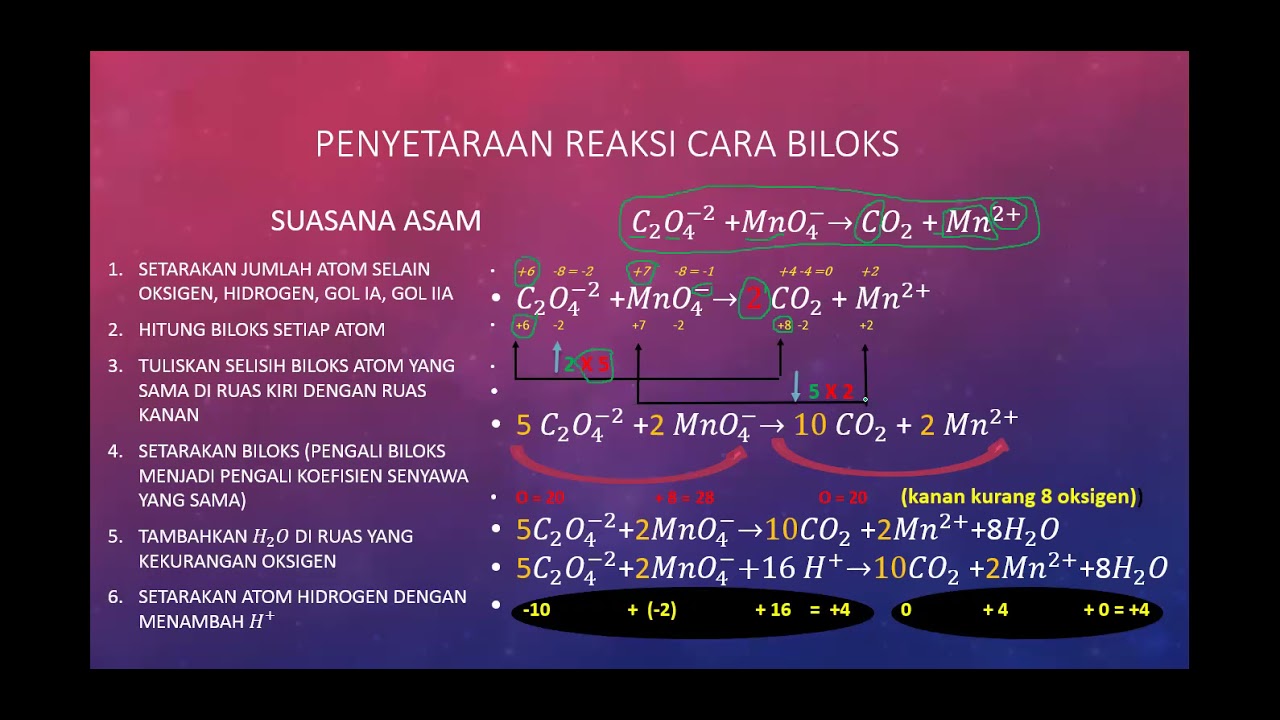
PENYETARAAN REAKSI REDOKS CARA BILOKS YouTube
Step 4: Substitute Coefficients and Verify Result. Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. Since there is an equal number of each element in the reactants and products of C2H2 = 2C + H2, the equation is balanced.

Aturan penentuan biloks
Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. Since there is an equal number of each element in the reactants and products of 2HCl + Po = PoCl2 + H2, the equation is balanced.

Penyetaraan Reaksi Redoks dengan Cara Biloks
Di artikel ini gue akan membahas lebih dalam tentang cara menentukan bilangan oksidasi hingga aturan biloks beserta contoh soalnya. Sebelumnya, elo udah belajar tentang cara menentukan reaksi redoks dan oksidasi. Kalau proses fotosintesis itu merupakan contoh reaksi redoks, di mana ada pengikatan atom H dan pelepasan atom O, sehingga atom H.