
Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Ion-ion pada klorin yang tidak dapat mengalami reaksi disproporsionasi adalah bilangan oksidasi klorin dalam senyawa yang memiliki bilangan oksidasi -1 dan +7 sekaligus. Untuk menentukan bilangan oksidasi klorin, sebagai berikut : Unsur klorin pada memiliki biloks +1, yang menunjukkan bahwa dapat mengalami reduksi dari +1 menjadi -1.

Bilangan Oksidasi Pengertian, Aturan dan Cara Menentukan
Bilangan oksidasi klorin terendah adalah -1 dan tertinggi adalah +7 . Pada spesi berikut klorin yang tidak dioksidasi lagi adalah a. NaCl b. Cl2 c. HClO2 d. NaClO3 e. HClO4. SD. SMP SMA. UTBK/SNBT. Produk Ruangguru. NR. Nazwa R. 29 Mei 2022 12:12. Iklan.
Bilangan Oksidasi Kimia Biloks Tabel Biloks Contoh Soal Dan Jawaban Riset
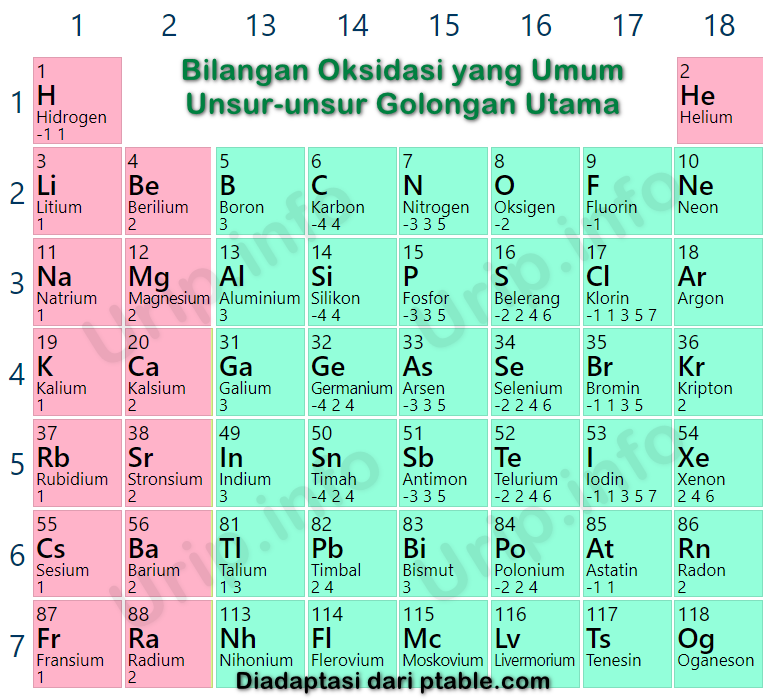
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Perhatikan kation yang memiliki bilangan oksidasi
Bilangan oksidasi terendah yang dimiliki unsur klorin adalah -1. 2. Fakta-Fakta Menarik Tentang Unsur Klorin. Unsur klorin adalah elemen kimia yang mempunyai simbol Cl dan nomor atom 17. Unsur ini memiliki warna hijau kuning dan berwujud gas pada suhu kamar. Unsur klorin adalah salah satu unsur yang penting dalam kehidupan manusia.

Menghitung Bilangan Oksidasi Unsur
Berikut adalah pengertian, aturan, cara menentukan, dan contoh soal tentang bilangan oksidasi dalam kimia.. Jumlah muatan positif dan negatif pada suatu atom inilah yang disebut dengan bilangan oksidasi atau biasa disingkat biloks/b.o.. Tentukan bilangan oksidasi atom unsur Cr dalam senyawa K2Cr2O7! Jawaban: Muatan K2Cr2O7 = (2 x b.o K.

Jelaskan Pengertian Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi
Dalam beberapa kasus, rata-rata bilangan oksidasi dapat berupa pecahan, seperti 8/3 pada besi dalam senyawa magnetit (Fe 3 O 4). Bilangan oksidasi tertinggi yang pernah dilaporkan adalah +9 pada kation iridium tetroksida (IrO 4 +). Sedangkan bilangan oksidasi terendah adalah -5 untuk boron, galium, indium dan talium pada banyak senyawa interlogam.

Unsur klor dalam senyawa dapat ditemukan dengan bilangan
Pengertian bilangan oksidasi adalah jumlah muatan positif atau negatif yang dimiliki oleh suatu atom dalam bentuk ion maupun senyawa. Dalam menentukan bilangan oksidasi (biloks) kita juga harus mengikuti aturan-aturan bilangan oksidasi yang telah ditetapkan oleh ilmuan-ilmuan terdahulu. Aturan-aturan bilangan oksidasi adalah sebagai berikut: Bilangan oksidasi atom dalam bentuk unsur bebasnya.

Cara Menentukan Bilangan Oksidasi Dunia Sosial
Nilai a dan b yang cocok adalah.. 2, 5. 2, 10, 1, 4. 1, 5. 3, 5. 3. Multiple Choice. Edit. 1 minute. Unsur Mn yang mempunyai bilangan oksidasi +2 terdapat pada senyawa.. Mn 2 O 3. MnO 2. KMnO 4. K 2 MnO 4.. Ca(NO 3) 2. NH 4 Cl (NH 4) 2 SO 4. 19. Multiple Choice. Edit. 30 seconds. 1 pt. Bilangan oksidasi unsur klorin tertinggi.

Aturan Penentuan Bilangan Oksidasi Materi Reaksi Redoks Kimia SMA Pojan.id YouTube

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Unsur nitrogen dengan bilangan oksidasi terendah terdapat...
Daftar isi [ Tutup] Pengertian Bilangan Oksidasi. Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan Oksidasi Berupa Unsur Bebas adalah 0 (nol) 2. Bilangan Oksidasi Ion Monoatom dan Poliatom = Muatan yang Dimiliki. 3. Bilangan Oksidasi Unsur Golongan IA, IIA, IIIA Sesuai Golongan Unsur Logam Tersebut.

g
Biloks dari ion seperti hidrida adalah sama dengan muatan ion, dalam hal ini adalah -1.' Bilangan oksidasi unsur H pada H 2 O, HCl, H 2 S, dan NH 3 adalah +1. Bilangan oksidasi unsur H pada NaH, CaH 2, dan AlH 3 adalah -1. 6. Bilangan oksidasi unsur O pada senyawanya adalah -2, kecuali:' 1. Pada senyawa biner dengan F, bilangan oksidasinya.

Cara Menentukan Bilangan Oksidasi dan Contohnya
Lihat pula: bilangan oksidasi dalam {{kotak info unsur}} Bilangan oksidasi juga dipelihara dalam artikel suatu unsur (tentu saja), dan secara sistematis dalam tabel {{Kotak info unsur/symbol-to-oxidation-state}} Pemeliharaan & peningkatan. Untuk pemeliharaan: kedua daftar dibandingkan dalam /datacheck ini, untuk mendapatkan perbaikan bersama.

Diketahui data unsur X sebagai berikut. Berikatan ion Jika bersenyawa dengan unsur klorin rumus
Pengertian bilangan oksidasi. Dilansir dari Chemistry LibreTexts, bilangan oksidasi adalah bilangan positif dan negatif yang diberikan pada suatu atom untuk menunjukkan tingkat oksidasi atau reduksinya. Bilangan oksidasi disebut juga sebagai biloks. Perubahan bilangan oksidasi dikarenakan oleh transfer elektron dalam reaksi redoks.

Cara Menentukan Bilangan Oksidasi Unsur Dalam Senyawa Kelas 10 YouTube
Bilangan oksidasi terendah yang dimiliki unsur klorin 17cl adalah Daftar Isi 1. Bilangan oksidasi terendah yang dimiliki unsur klorin 17cl adalah 2. Bilangan oksidasi klorin yg terendah terdapat pada zat? 3. Bilangan oksidasi klorin yg terendah terdapat pada zat 4. unsur Mn dengan bilangan oksidasi terendah terdapat pada senyawa 5. Bilangan oksidasi untuk unsur oksigen.

Cara Menentukan Bilangan Oksidasi Matob
Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik.Bilangan ini menggambarkan tingkat oksidasi (kehilangan elektron) dari sebuah atom dalam senyawa kimia.Secara konseptual, bilangan oksidasi dapat berupa bilangan positif, negatif, atau nol. Walaupun ikatan ionik sepenuhnya tidak.